
【题目】我国民间有端午挂艾草的习俗。艾草含有丰富的黄酮素(化学式为C15H10O2),有很高的药用价值。请回答:
(1)黄酮素含有______种元素,碳、氢的原子个数比是______(最简整数比)。
(2)黄酮素的相对分子质量是______。
(3)黄酮素中碳、氢、氧元素的质量比为______。
(4)黄酮素分子中碳元素的质量分数是为______(计算结果精确到0.1%)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】某同学在研究物质燃烧条件时,做了如图所示的实验,将一根光亮的铁丝绕成线圈罩在一支燃着的蜡烛火焰上,火焰很快熄灭了,原因是_____________________。若将该铁丝圈放在高温下灼烧,看到的现象是_______,把铁丝圈取出冷却后铁丝表面呈黑色。试写出铁丝在高温时与空气反应的化学方程式:______________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国拥有丰富的海洋资源,开发利用这些宝贵资源可有力地促进我国经济的发展。
从海水中提取出的粗盐中除了NaC外,还含有泥沙等杂质,下面是粗盐提纯的部分步骤。
![]()
请认真分析后,完成下列问题:
①操作1的名称是_____。
②在过滤操作中要用到的玻璃仪器有烧杯、漏斗、_____(填仪器名称)。
③在加热蒸发过程中,当蒸发皿中_____时,停止加热。
④经过以上步骤得到的食盐中还含有 CaCl2、MgCl2、Na2SO4等可溶性杂质,为除去杂质中的Na2SO4,应加入的物质是_____
A.BaCl2溶液
B.NaOH溶液
C.Na2CO3溶液
D.盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某汽水中含有柠檬酸,其化学式是C6H8O7;下列说法正确的是( )
A. 柠酸是氧化物
B. 柠檬酸中碳、氢、氧三种元素质量比6:8:7
C. 8g柠檬酸中含3g碳元素
D. 柠檬酸由碳、氢、氧三种原子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】美国普林斯顿大学的研究人员设计出利用太阳光能将二氧化碳和水转化为潜在替代燃料甲酸(CH2O2)的有效方法。该研究成果的简要流程如下:
![]()
(1)请根据题意推测甲酸的一种化学性质:_____,将二氧化碳和水转化为潜在替代燃料甲酸,这种转化过程属于_____(选填“物理变化”或“化学变化”)。
(2)二氧化碳是一种重要的化工原料,它可以用来制取碳酸饮料,该反应的化学方程式为_____。由题对比可见,反应物相同但产物却不同,说明化学反应的产物不仅决定于反应物,还决定于_____。
(3)由二氧化碳转化为甲酸,你得到的启示是_____。
(4)化学就在身边,生活离不开化学:
A、为了防止人体缺乏碘元素,工人们在市售食盐中添加了少量的碘酸钾(KIO3)。碘酸钾的化学性质与氯酸钾的化学性质相似,试写出碘酸钾在加热条件下分解的化学方程式_____。
B、硫酸型酸雨的形成主要经过以下两步:①SO2在空气中被粉尘催化氧化得到SO3,②SO3与水化合形成硫酸;其中反应②形成硫酸的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生产、生活中常需配制溶液。

(1)配制一瓶如图所示溶液需氯化钠________g。
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?请说明偏小的原因。①用量筒量取水时仰视读数;②往烧杯中加水时有水溅出;③称量含不溶性杂质的氯化钠来配制溶液;④将配制好的溶液往试剂瓶中转移时有少量溅出。
_______________________________________________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜镁合金具有优良的导电性,常用作飞机天线等导电材料。科研小组欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10 克放入烧杯,将140克稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量,数据记录如表,请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/克 | 35 | 35 | 35 | 35 |
剩余固体质量/克 | 8.8 | 7.6 | 6.4 | 6.0 |
(1)合金中镁与铜的质量比为_____。
(2)所加稀硫酸的溶质的质量分数______________。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )

A. 降低温度可使接近饱和的甲溶液变成饱和溶液
B. 10℃时甲、乙两种溶液的溶质质量分数一定相等
C. 将甲、乙两种物质的饱和溶液从10℃升温到35℃时,两溶液的溶质质量分数都变大
D. 35℃时,100g甲的溶液中含甲的质量60g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如表为元素周期表中部分元素的相关信息,请利用如表回答相关问题。
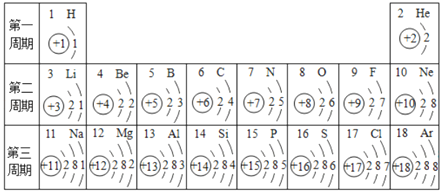
(1)碳原子的核电荷数是_____。
(2)12号元素的原子在化学反应中比较容易_____(填“得到”或“失去”)电子。
(3)在同一周期中,从左到右各元素的原子最外层电子数逐渐_____。
(4)一定条件下,将2.4gCH4与8.0g由8号元素组成的单质,在点燃条件下恰好完全反应,生成5.4gH2O、2.2gCO2和物质X,该化学方程式为3CH4+5O2![]() CO2+6H2O+2X,则X的化学式是_____。
CO2+6H2O+2X,则X的化学式是_____。
(5)将镁、钙、铁、铜四种等质量的金属投入到足量的稀硫酸中,反应速度最快的是_____,产生氢气最多的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com