
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①硝酸钾和氯化钠的溶解度相同时的温度范围是_______;
A 0°C-20°C B 20°C-40°C C 40°C-60°C D 60°C-80°C
②20°C时,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是_______;要进一步提高该溶液的溶质质量分数,可进行的操作是_______。
③在80°C的100g水中溶解NaCl和KNO3,进行以下实验,己知溶液a中的硝酸钾恰好饱和:
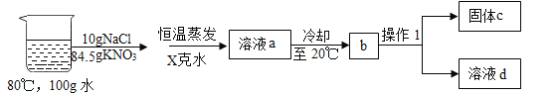
Ⅰ. 操作1的名称是______;
Ⅱ. X=_______克,固体C的成分和该成分的质量分别是______和________;
Ⅲ. 对整个实验过程分析正确的是________;
A 40°C-60°C开始析出晶体
B 氯化钠在整个过程中一直保持不饱和状态
C 上述方法不能将氯化钠和硝酸钾完全分离
D 原溶液直接降温结晶,析出硝酸钾的质量不变
【答案】B 65.8g 升高温度 过滤 50 硝酸钾 68.7g BC
【解析】
①由表中数据可知,硝酸钾和氯化钠的溶解度相同时的温度范围是20°C-40°C,故选B。②20°C时,KNO3的溶解度为31.6g,则50g水中最多能溶解15.8gKNO3,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是15.8g+50g=65.8g。由于KNO3的溶解度随温度的升高而增大,故要进一步提高该溶液的溶质质量分数,可进行的操作是升高温度。
③Ⅰ.通过过滤可将难溶于水的固体物质与液体分离,故操作1的名称是过滤;
Ⅱ.80°C时,硝酸钾的溶解度是169.0g,溶液a中溶有84.5g硝酸钾恰好饱和,说明此时水的质量为50g,X=100g-50g=50g。根据硝酸钾的溶解度可知,20°C时,50g水中最多能溶解硝酸钾的质量为15.8g,则固体C中硝酸钾的质量为84.5g-15.8g=68.7g。氯化钠的溶解度受温度影响较小,从80°C降温至20°C过程中没有析出,所以固体C是68.7g的硝酸钾;
Ⅲ. A 硝酸钾的溶解度随温度的升高而增大,溶液a中的硝酸钾恰好饱和,温度小于80°C,硝酸钾就有晶体析出,此选项错误;
B 氯化钠的溶解度受温度影响较小,在整个过程中一直保持不饱和状态,此选项正确;
C 硝酸钾总会溶解,氯化钠的溶解度受温度影响较小,上述方法不能将氯化钠和硝酸钾完全分离,此选项正确;
D 原溶液中溶剂质量为100g,a溶液中溶剂质量为50g,故原溶液直接降温结晶,析出硝酸钾的质量减少,此选项错误。故选BC。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源: 题型:
【题目】下图所示为实验室中常见的气体制备和收集装置。
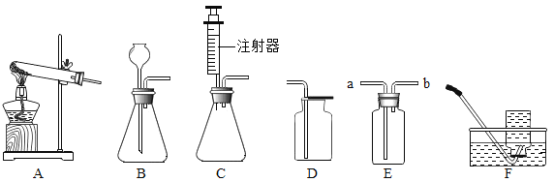
①实验室用加热高锰酸钾制取氧气,应选用一套装置是__________(填字母序号),反应的符号表达式为__________________________。
②若用F装置收集氧气,_______________开始收集;若用装置D收集氧气,验满的方法是_________________________________。
③实验室用过氧化氢溶液和二氧化锰制取氧气,若选用B做发生装置,加入药品前应________________,写出该反应的符号表达式___________________________。
④若选用C做发生装置,你认为选用C的优点是____________________________。
⑤欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从__________(填“a”或“b”)端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲测定一份铜和锌混合物中锌的质量分数(铜和稀硫酸不反应),进行了如下实验。称量一定量铜和锌混合物放入烧杯中再加入100克质量分数为10%的稀硫酸,在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设匀速进行,烧杯质量25g)
反应时间(m) | 2 | 4 | 6 | 8 | 10 |
烧杯和剩余物的质量(g) | 134.97 | m | 134.91 | 134.90 | 134.90 |
请计算:
(1)表中“m”为_____g;
(2)该锌混合物中锌的质量分数?_____(写过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学对铜及其化合物进行了相关探究。
(实验回顾)用如图 1 所示装置,利用铁生锈的原理可以比较准确地测出空气中氧气的含量。
(提出问题)若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气 中氧气的含量?
(查阅资料)铜能与空气中氧气、水、二氧化碳反应生成铜绿,化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
(交流与讨论)若将图2 装置中的细铁丝换成足量的细铜丝进行实验,________(填“能” 或“不能”)比较准确地测出空气中氧气的含量,理由是________。
(拓展探究)工业上可用废铜屑、空气与稀硫酸在 80℃条件下制备硫酸铜。
①如图 3是实验室拟工业制备硫酸铜的装置,采用水浴加热的优点是________, 多孔球泡的作用为________。
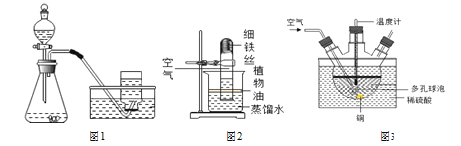
②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是________。
③用如图 1所示装置制备氧气,反应的化学方程式为________, 收集一瓶氧气的方法是:当气泡连续均匀冒出时,把导管伸入盛满水的集气瓶中,氧气充满 集气瓶后,________,把集气瓶拿出水槽,正放于实验桌。
(定量分析)称取 14.4g 仅含 Cu、O 两种元素的固体样品,采用如图 4 所示装置实验(夹 持装置省略)。完全反应后,测得实验前后装置 B 增重 4.4g。
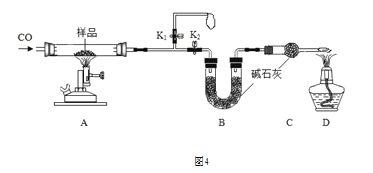
①实验开始前应先关闭________,打开________。
②装置 B 的作用是________。
③铜元素有多种氧化物,如 CuO、Cu2O。根据实验数据进行计算,该固体样品成分可能是______(填序号)。
A.Cu2O B.Cu、CuO C.CuO、Cu2O D.Cu、CuO、Cu2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示X、Y、Z三种物质的溶解度曲线,下列说法错误的是
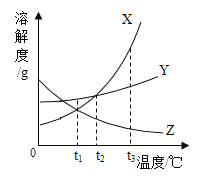
A.Y中含有少量X,用海水晒盐的原理提纯Y
B.t3°C时,X、Y的饱和溶液降温到t2°C,析出晶体较多的是x
C.t1°C时,三种物质的饱和溶液升温到t2°C,溶液中溶质质量分数的大小关系是Y>X>Z
D.t3°C时, 等质量的X、Y分别配成该温度下的饱和溶液,所得溶液质量X<Y
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验是进行科学探究的重要方式。请根据下图所示装置回答有关问题:

(1)用实验一所示装置探究化学反应前后物质的总质量是否发生改变,反应前托盘天平的指针指向刻度盘的中间,则容器内的两种物质反应后,托盘天平的指针_____(选填“向左”、“向右”、“不”)偏转,原因是_____。
(2)实验二中,将完全相同的两只纸船分别放在薄铜片的两侧,向其中一只加入一半水,加热铜片的中部,观察到不装水的纸船很快燃烧,装水的纸船不燃烧,通过此实验,可说明燃烧的条件之一是_____。
(3)对比实验三中木炭在空气中和在氧气中燃烧的实验现象,说明可燃物燃烧的剧烈程度与_____有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小瑾同学按下图所示进行了有关金属性质的探究实验。下列有关说法中,错误的是( )。
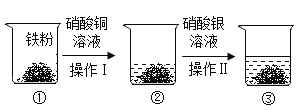
A.烧杯②中的溶液可能呈蓝色
B.烧杯②中的固体可能为铜和铁的混合物
C.烧杯③中的溶液中,一定含有 Fe2+、Cu2+、Ag+
D.烧杯③中的固体质量一定大于烧杯②中的固体质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com