
【题目】用化学用语表示:
(1)2个镁离子_______________;(2)氢氧化亚铁______________;
(3)保持二氧化硫的化学性质的最小粒子_______________。
科目:初中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)主要用于制造手机、笔记本电脑及其它便携式电子设备锂离子电池的正极材料。已知LiCoO2中Li元素的化合价为+1,则Co元素的化合价为:
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
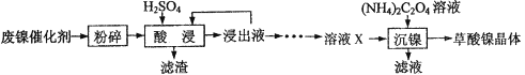
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
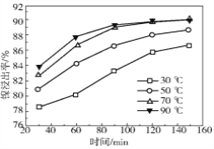
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置,结合所学化学知识回答下列问题。
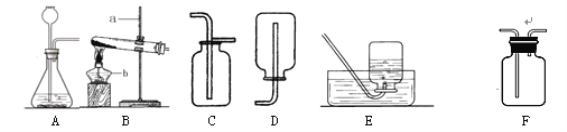
(1)写出标号仪器a的名称:__________。
(2)实验室若选择装置B用高锰酸钾制取氧气时,你认为B装置存在的问题是_________,该反应的化学方程式是_________;实验结束后要先将导管移出水面,后熄灭酒精灯的原因是________。
(3)实验室里,常用亚硫酸钠固体和浓硫酸反应制取SO2;通常情况下,SO2是一种无色、有刺激性气味的有毒气体,密度比空气大,易溶于水且水溶液显酸性。实验结束后多余的SO2气体要用氢氧化钠溶液吸收,反应的化学方程式为:__________________________。为便于处理多余的有毒气体,实验室制取并收集SO2气体可以选择装置______(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(一)实验课上,甲组同学运用下列实验方法探究碱的性质。
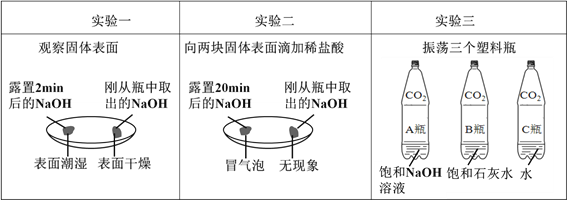
①由上图实验一可知,氢氧化钠会吸收空气中的_______,此变化过程属于____ (填“物理变化”或“化学变化”)。
②由上图实验二可知,氢氧化钠会吸收空气中的______而变质,因此要密封保存。
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与____ (选填“B”或“C”)瓶的实验现象可证明CO2 能与NaOH发生反应。
(二)乙组同学设计了如图所示的装置中,集气瓶内充满二氧化碳气体,瓶口的双孔塞一孔插一根连接气球的玻璃管,另一孔插一支盛有氢氧化钠溶液的胶头滴管。把胶头滴管中的氢氧化钠溶液滴入瓶中,振荡。

①实验现象:________________________,
反应的化学方程式为________________________;
②小明对瓶底残留液的成分产生了兴趣,欲探究其中是否含有碳酸钠:
实验操作 | 实验现象 | 实验结论 | |
方法1 | 取样,滴加稀盐酸 | ______ | 含有碳酸钠 |
方法2 | 取样,滴加氢氧化钙溶液 | 产生_______ |
小明又取样于试管中,滴加无色酚酞试液,酚酞变红,由此也得出瓶底残留液中只含有碳酸钠的结论。稍后想想又立即否定了自己的结论,理由是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)下图是硝酸钾和氯化钾固体的溶解度曲线。
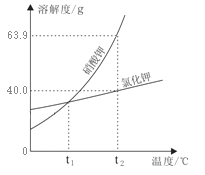
① t1℃时,硝酸钾溶解度______(填“大于”、“等于”或“小于”)氯化钾。
② t2℃时,将等质量的两种固体分别加入100 g水中,充分搅拌后观察到:硝酸钾完全溶解、氯化钾有剩余。则加入的固体质量(m)的取值范围是______________。
③ 将t2℃时的两杯各盛有100 g硝酸钾、氯化钾饱和溶液分别降温到t1℃,下列叙述正确的是___________(填标号)。
A.析出硝酸钾晶体质量小于氯化钾
B.硝酸钾溶液与氯化钾溶液的溶质质量分数相等
C.硝酸钾溶液中溶剂质量大于氯化钾溶液中溶剂质量
(2)某化学小组欲从含有少量氯化钾的硝酸钾样品中,提纯硝酸钾固体。
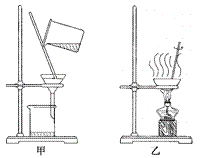
① 可采用的提纯方法是__________(填标号)。
A.冷却热饱和溶液 B.蒸发结晶
② 在提纯过程中,应选择图中_____(填“甲”或“乙”)装置进行分离,该操作中玻璃棒的作用是______________________。
③ 为检验得到的硝酸钾固体是否含有氯化钾,可使用酸化的硝酸银(AgNO3)溶液来检验,该检验方法的原理为_________________(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】纯碱是化学工业生产中一种非常重要的化工原料。
反应原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,
2NaHCO3══Na2CO3++H2O +CO2↑
已知:常温下氨气极易溶于水,1体积水大约可以溶解700体积的氨气;二氧化碳可溶于水,1体积水大约可以溶解1体积二氧化碳。
某课外活动小组模拟工业流程来制备纯碱,实验装置、所需实验药品和装置如图所示:
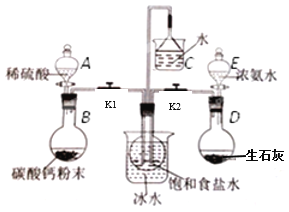
实验步骤:
(1)搭好装置并________________。
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中; D中加入足量生石灰固体,E中加入足量浓氨水,利用该方法制取氨气的原理是_________________________(写一点即可),根据该原理,生石灰也可以用_________固体代替;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入),写出该反应的化学方程式________________,选择用稀硫酸而不用稀盐酸的理由是___________________________。
(3)制备NaHCO3:先打开弹簧夹________(填K1或K2),使对应一侧烧瓶中生成的气体进入饱和食盐水,大约20分钟左右时,再打开另一个弹簧夹,使其一侧的烧瓶中生成的气体进入饱和食盐水,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。这种气体通入先后顺序的目的是_____________________________。
在该实验过程中,中间的烧瓶浸入冰水中的目的:___________________________。
(4)制备纯碱:欲得到纯碱,上述实验结束后,将固体过滤、洗涤后,还需进行的操作是_____;若将制得的纯碱放入足量的稀硫酸中,并将生成的气体全部通入氢氧化钠溶液中,溶液质量增加0.88g,则步骤(3)中制得的NaHCO3的质量是多少?(写出计算过程)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com