
【题目】(1)酒中所含酒精的化学名称是乙醇,乙醇被广泛应用于生产新型环保燃料乙醇汽油,乙醇汽油在一定程度上能够缓解能源危机,乙醇汽油属于_____(填“纯净物”或“混合物”)。
(2)乙醇是一种无色具有醇香味的液体,易溶于水,易燃烧,是一种常用的有机溶剂,也是一种常用的燃料。以上描述中,属于化学性质的是_____。
(3)乙醇燃烧能够释放大量热量,是一种优质能源,乙醇燃烧的化学方程式为_____。
(4)已知某酒精(C2H5OH)溶液中,氢元素的质量分数为12%,则该溶液中溶质的质量分数为_____。
A 25% B 46% C 54% D 75%
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系如图所示.其中合理的是(已知:Al(OH)3+KOH═KAlO2+2H2O;2KAlO2+CO2+3H2O═2Al(OH)3↓+K2CO3;CO32﹣+CO2+H2O═2HCO3﹣)( )
A. 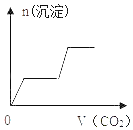 B.
B. 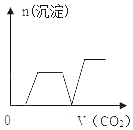
C. 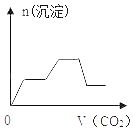 D.
D. 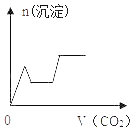
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:
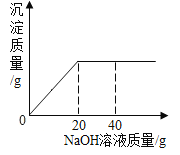
请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液_____克时,硫酸铜与氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数为_________(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你参与下列探究:
(问题情景)某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2
(查阅资料)SO2易溶于水,它能与NaOH反应,生成Na2SO3
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则可用___________进行检验。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式 ____________。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。如果放出的是O2和H2,你认为方案中的安全隐患是_____________ 。
丙同学认为:为确保安全,实验前应先收集一试管气体,进行_______实验,方可采用下面的装置进行实验。
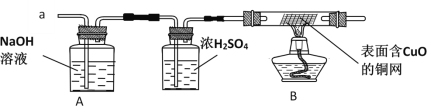
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
结论:铁粉与硫酸铜溶液反应时,产生的气体是_____________。
(思维拓展)
经检验发现,该硫酸铜溶液中只含有一种阴离子,则由上述实验可以推出,硫酸铜溶液中含有的阳离子是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将质量为44.4克含有少量NaCl 的纯碱晶体(Na2CO3nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解)。
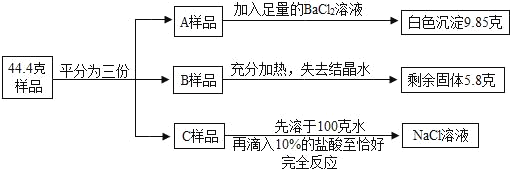
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是_____。
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是_____克。
(3)B样品中含有结晶水的质量是_____克。
(4)化学式Na2CO3nH2O中n是_____
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少_____?(精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上炼铁炼钢和轧制钢材的主要流程如下图
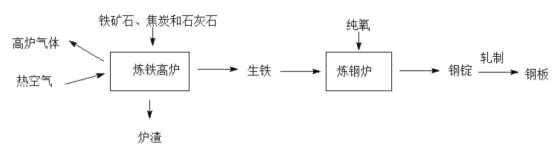
已知生铁的含量含碳量为 2%-4.3%钢的含碳量为 0.03%-2%。
(1)反应:①Fe2O3+CO ![]() 2Fe+3CO,②Fe2O3+C
2Fe+3CO,②Fe2O3+C![]() 2Fe+3CO。属于置换反应的是 ,用于高炉炼铁的原理是 (填序号)
2Fe+3CO。属于置换反应的是 ,用于高炉炼铁的原理是 (填序号)
(2)炼铁的固体原料需经过粉碎,其目的是 。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是 。 炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是 。
(4)炼钢炉中,通入纯氧的目的是 。将钢锭轧成钢板,体现了 金属的 性。
(5)钢铁制品可能会生锈,写出用稀硫酸除锈反应的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列如图所示图象中有关量的变化趋势与对应叙述关系正确的是( )
A. 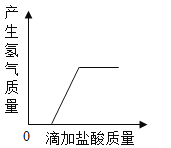 向一定质量的打磨光亮的锌片中滴加盐酸
向一定质量的打磨光亮的锌片中滴加盐酸
B. 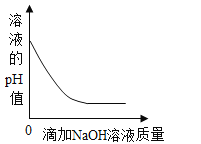 向一定质量的稀硫酸中滴加氢氧化钠溶液
向一定质量的稀硫酸中滴加氢氧化钠溶液
C. 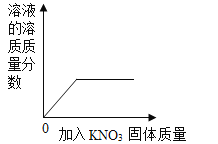 一定温度下向一定量水中加入KNO3固体
一定温度下向一定量水中加入KNO3固体
D. 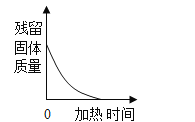 加热一定质量的高锰酸钾制取氧气
加热一定质量的高锰酸钾制取氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NSR 技术通过 BaO 和 Ba(NO3)2 的相互转化实现 NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的 NOx 排放。其工作原理如图所示。下列说法不正确的是
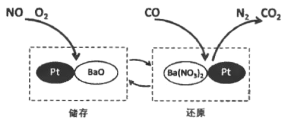
A. 降低 NOx 排放可以减少空气中酸雨的形成
B. 储存时,吸收 NOx (如 NO, NO2)的物质是 Pt
C. 还原时,发生的反应是: ![]()
D. 若有 28 g CO 参与反应,则生成 CO2 的质量为 44g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
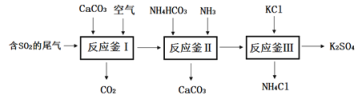
⑴钾肥K2SO4对农作物生长的作用是___________。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为________;
②CaO + SO2==CaSO3 ③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为____________(填字母序号,如图为几种盐的溶解度曲线)。
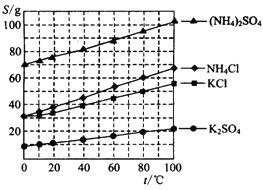
A.0℃-10℃ B. 20℃-30℃ C. 60℃-65℃ D. 80℃-90℃
⑷上述工艺流程中循环利用的物质是_______;证明产品K2SO4中不含杂质的实验方法是_______写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
(步骤I)制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
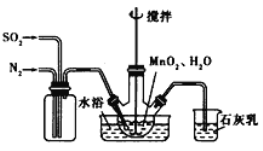
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为________。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为____________。
⑺步骤I中,先通入氮气的目的是_________。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、_______(任写1条)。
(步骤II)制备MnSO4H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4H2O晶体。
(步骤III)制备Mn3O4固体:准确称取101.4mg MnSO4H2O,将MnSO4H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
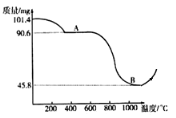
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com