
【题目】某安氟醚麻醉剂标签的部分说明书如图。请回答:

(1)安氟醚是由_______种元素组成。
(2)每瓶安氟醚的质量是_______g。
(3)安氟醚中碳、氢、氧、氟、氯的原子个数比是_______。
(4)从保存及用法方式看安氟醚的物理性质是__________。
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源: 题型:
【题目】模型是联系宏观与微观的桥梁。
(1)图1是元素周期表中的一部分,图2 是溴原子的结构示意图。据图回答问题:
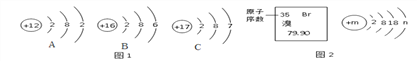
①图2中n的值为_________,溴元素与图1中_______(填字母)化学性质相似。
②写出溴和A形成化合物的化学式_________________。
(2)下图是氢分子和氧分子运动的示意图。

①在A、B、C中,能比较得出“温度越高,分子运动速率越快”是______(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与 __________ 有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:__________________ 。
(3)下图是某化学反应的微观示意图:已知:“![]() ”代表A分子,“
”代表A分子,“![]() ”代表B分子,“
”代表B分子,“![]() ”代表C分子)
”代表C分子)

写出该反应的化学方程式_________________________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】资源与能源已成为人们日益关注的焦点。试回答:
(1)海水含量最多的盐类物质是________(填化学式)。
(2)在汽油中加入适量乙醇(C2H5OH)作为汽车燃料。写出乙醇充分燃烧的化学方程式_____。
(3)工业用焦炭、铁矿石、石灰石、空气为原料炼铁,炼铁的设备为_______,写出一氧化碳与赤铁矿反应的化学方程式___________,其中利用了一氧化碳的______(填“氧化性”或“还原性”)。
(4)每年因腐蚀而报废的金属数量惊人,写出生活中防止铁生锈的措施______(答一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂。下图是以生锈的废铁屑为原料制备PFS的一种工艺流程。
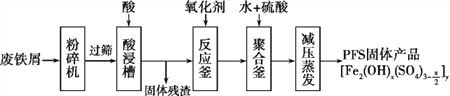
下列说法的错误的是
A. 粉碎过筛的目的是为了增大反应物的接触面积,提高“酸浸”的反应速率
B. 酸浸槽中加入的酸应选择硫酸
C. 酸浸槽中存在的金属阳离子只含Fe2+
D. 相对于常压蒸发,减压蒸发的优点是防止温度过高聚合硫酸铁分解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】题图是a、b两种物质的溶解度曲线,下列叙述不正确的是
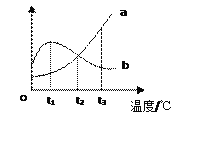
A. b物质的饱和溶液在t1℃时浓度最大
B. t2℃时,a、b两种物质的饱和溶液浓度相同
C. a中含有少量b时可采用蒸发浓缩,冷却结晶的方法分离
D. t3℃时,溶液的溶质质量分数a物质一定大于b物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、MgO等。研究小组对其进行综合处理的流程如下:
资料1:SiO2、Al2O3溶于浓氢氧化钠溶液。
资料2:MgCl2溶液加热容易水解生成Mg(OH)2。
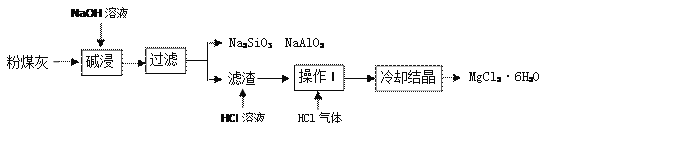
(1)碱浸溶解SiO2(性质与CO2相似)的化学反应方程式为_____________。
(2)粉煤灰碱浸需在较高温度下进行,原因是__________________。
(3)滤渣中加入稀盐酸发生的化学反应方程式是____________________。
(4)操作I是_________________,通入HCl气体的目的是_________________。
(5)化石燃料除煤外还有____________,人们开发和应用的清洁能源有_________(写出两种即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程如下:
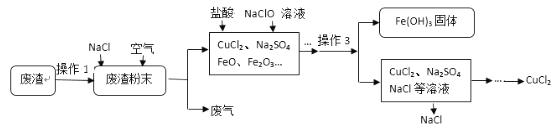
(1)操作1是:粉碎,将废渣粉碎的目的是_____________________________。
(2)操作3的名称是_________,其中玻璃棒的作用是__________________。
(3) 已知CuS与氧气反应生成两种常见氧化物,写出化学方程式__________________;
(4)上述工艺流程中可循环利用的物质是__________。NaClO中氯元素化合价____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明用木炭粉还原氧化铜来制取铜,反应化学方程式为:______.
他根据碳的化学性质分析,认为该实验中可能会有一氧化碳产生.
【查阅资料】一氧化碳气体能使湿润的黄色氯化钯试纸变蓝色.
【设计实验】小明设计了下图所示的实验装置,并进行实验验证:
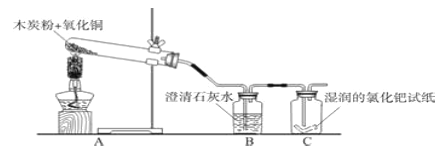
(1)A装置中酒精灯加网罩的目的是_______.
(2)刚用酒精灯给试管A加热时,B装置中就立刻产生气泡,但液体并没有浑浊的现象出现,原因是______.
(3)C中湿润黄色氯化钯试纸变蓝,说明有_____气体生成,证明小明的判断是正确的.你觉得实验产生该气体的原因可能是(写一条):______.
(4)设计装置时还要考虑环保因素,因此,要在装置C右侧导管口添加____装置.
(5)当反应结束后,小明发现一个问题:若先停止加热,______而导致试管炸裂,但若先去除B装置,则会导致________.请你帮助他设计一个实验操作,将试管中还原出的铜倒出:_________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知NaHCO3在270 ℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案。
方案一:样品![]() 测定生成CO2的质量。
测定生成CO2的质量。
(1)NaHCO3俗称_______,本实验采用如图所示的装置,C中盛放的物质是_______。
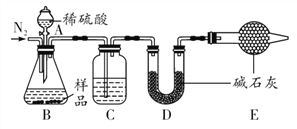
(2)若无装置E,在其他操作正确的情况下,_______(填“能”或“不能”)准确测定样品中NaHCO3的质量分数。
(3)在其他操作正确的情况下,不能将分液漏斗中的稀硫酸改为稀盐酸的原因是___________。
方案二:样品![]() 测定剩余固体质量
测定剩余固体质量
具体操作步骤如下:
①取一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(4)实验时需要重复“加热、冷却、称量”操作多次,其目的是__________________。
(5)根据题目中的信息,写出NaHCO3完全分解的化学方程式__________________。
(6)根据题意,计算样品中NaHCO3的质量分数为_____________。(请写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com