
����Ŀ�����ᡢ����ε��ܽ��Ա������£�����ѧϰ��ѧ����Ҫ���ߣ��ǻ�С��ͬѧ���øù��߽���̽��ѧϰ��
̽���һ����ʶ����
����ͼ�����б�ע�˼ס��ҡ������������������ʣ����ʵ��ܽ��Ծ�δ������
�����ᡢ����ε��ܽ��Ա������£�
������ ������ | OH�� | NO3�� | Cl�� | SO42�� | CO32�� |
K�� | �� | �� | �� | ||
Ba2�� | �� | �� |
��1����ʶ���ţ�NO3��������___________��
��2��д��ѧʽ�������ʵĻ�ѧʽ��_______________��
��3�����ʷ��ࣺ���������У����ڼ����__________���û�ѧʽ��ʾ����
��4���ܽ����������������У�ֻ��һ�ֲ�����ˮ������____________���û�ѧʽ��ʾ����
̽����������ù���
��һ����ɫ��ĩ���ܺ����Ȼ�����̼�ᱵ��̼���ơ��������ƺ��������е�һ�ֻ��֣�ȡһ�����÷�ĩ��Ʒ���뵽ʢ������ˮ���ձ��У����裬���ã��۲쵽�ձ����а�ɫ�����С֣ͬѧ���ձ��е����ʹ��ˣ�������A����ҺB��ȡ����A���Թ��еμӹ���ϡ���ᣬ�۲쵽����ȫ���ܽ⣬�����ݲ�����
С��ͬѧ��һ�����������ʵ�鷽����ȷ����ɫ��ĩ����ɣ�

�������ʵ�鷽���и����������С��ͬѧ����������ֲ�ͬ�ļ��裬����ÿ�ּ����и����費ͬ��ʵ�����ɵó���ͬ��ʵ����ۡ�
����һ | ����� | ������ | |
����һ | �а�ɫ�������� | ||
����� | �ް�ɫ�������� | ��Һ��� | �ܱ�Ϊ��ɫ |
������ | �ް�ɫ�������� | ���������� | ���������� |
��1�����ݼ���һ������ȷ��ԭ��ɫ��ĩ��ֻ����̼�ᱵ��̼���ơ��������ƺ��������������ʡ��������������____________����������������_____________���������з���������һ����ѧ��Ӧ�Ļ�ѧ����ʽ��_________________��
��2�����ݼ����������ԭ��ɫ��ĩ���ܵ������_______________������дһ�ֿ��ܵ���ɣ��û�ѧʽ��ʾ��
��3�����ݼ�����������ԭ��ɫ��ĩ���ܵ������___________�֡�
���𰸡� ����� K2SO4 KOH BaCO3 ��Һ����ɫ��ɺ�ɫ ��Һ�ɺ�ɫ�����ɫ�������ݲ��������������ܽ� BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2�� ��NaOH + HNO3 = NaNO3 + H2O NaOH BaCO3
��NaOH BaCl2 Na2CO3��NaOH BaCl2 BaCO3��NaOH BaCO3 Na2CO3 BaCl2����дһ�ֿ��ܵ���ϣ� 4
��������̽���һ��(1)NO3����������������ӣ�(2)��K+�ɵü�Ԫ�صĻ��ϼ�Ϊ+1�ۣ�SO42���ɵ�������Ļ��ϼ�Ϊ-2�ۣ��������ӽ���γ����ʵĻ�ѧʽ�ǣ�K2SO4��(3)����ָ����ʱ���ɵ�������ȫ�������������ӵĻ�����������������У����ڼ���Ǽף��������أ���ѧʽΪ��KOH��(4)̼�ᱵ������ˮ����ѧʽΪ��BaCO3��̽�������̼�ᱵ������ˮ�������ᣬ̼���ƺ��Ȼ�����Ӧ�����������̼�ᱵ�����������ƺ��Ȼ�����Ӧ���ɲ�����������ᱵ������������ȡһ�����÷�ĩ��Ʒ���뵽ʢ������ˮ���ձ��У����裬���ã��۲쵽�ձ����а�ɫ�����С֣ͬѧ���ձ��е����ʹ��ˣ�������A����ҺB��ȡ����A���Թ��еμӹ���ϡ���ᣬ�۲쵽����ȫ���ܽ⣬�����ݲ��������Է�ĩ��һ�����������ƣ������������ԭ�е�̼�ᱵ���������Ȼ�����̼���Ʒ�Ӧ����̼�ᱵ�������ܺ����������ƣ�������ҺB�п��ܺ����Ȼ�����̼�����е�һ�֣�Ҳ���ܺ��������ƣ��������ƣ�������(1)���ݼ���һ������ȷ��ԭ��ɫ��ĩ��ֻ����̼�ᱵ��̼���ơ��������ƺ��������������ʣ�̼���ơ�������������Һ���Լ��ԣ�̼���ƺ�ϡ���ᷴӦ���ɶ�����̼���壬���Բ��������������Һ���ɫ���������������ǣ������ݲ������������з����ķ�Ӧ���������ƺ����ᷴӦ���������ƺ�ˮ����ѧ����ʽ�ǣ�NaOH+HNO3=NaNO3+H2O��(2)������������ᱵ���ް�ɫ�������ɣ�����B��һ�����������ơ�̼���ƣ������̪����Һ���ɫ��B�п��ܺ���̼���ƻ��������ƣ��μ����ᣬ��Һ��ɫ��������ҺB��һ�������������ƣ�����ԭ��ɫ��ĩ���ܵ�����ǣ�NaOH��BaCO3��(3)������������ᱵ���ް�ɫ�������ɣ�����B��һ�����������ơ�̼���ƣ������̪��û����������B�в�����̼���ƻ��������ƣ��μ����ᣬû����������������ҺB��һ������̼���ƣ�����ԭ��ɫ��ĩ���ܵ�����У�̼�ᱵ�������ƣ�̼�ᱵ���Ȼ�����̼�ᱵ���Ȼ�����̼������̼������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ 1 ��ʾ��ʵ������ȡ������װ��ͼ���밴Ҫ��ش���������
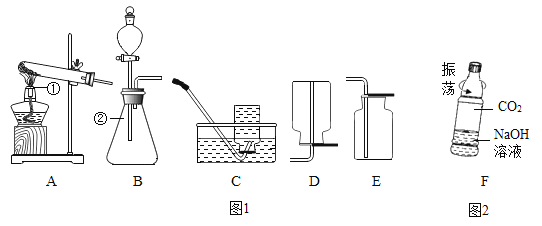
(1)д��ͼ�б����������������____����_____��
(2)ʵ�������������ȡ���ռ�һƿ�����������Ӧѡ�õ�װ�������_____(����ĸ���)
(3)������غͶ��������Ʊ�����ʱ�����������ڷ�Ӧ�е�������_______�� �����������̷��벢���ճ�ַ�Ӧ���ʣ����壬��ش���������
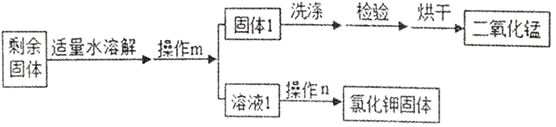
���� m ��������_______ ������ m �Ͳ��� n �ж��õ��IJ���������________��
(4)ʵ �� �� �� �� �� �� ̼ �� �� �� �� �� �� ̼ �� �� �� Ӧ �� �� ѧ �� �� ʽ Ϊ _________ ����ͼ 2 �� F ��ʾ�Ŀ�Ȫˮƿ���жԱ�ʵ�飬�� ��֤�� CO2 �� NaOH ��Һȷʵ�����˷�Ӧ��Ӧ���ĶԱ�ʵ����_______��CO2 �� NaOH ��Һ��Ӧ�Ļ�ѧ����ʽΪ___________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʢ����÷����÷�к��зḻ��Ҷ�ᣬ�Է��������л������ã��仯ѧʽΪCl9Hl9N7O6�������й�Ҷ���˵������ȷ����
A��Ҷ�����Է�������Ϊ441 g
B��Ҷ���е�Ԫ�ص���������������Ԫ�ص���������
C��Ҷ����̼���⡢����������Ԫ��������Ϊ19��19��7��6
D��Ҷ����19��̼ԭ�ӡ�19����ԭ�ӡ�7����ԭ�Ӻ�6����ԭ�ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѩͬѧ���Ȼ�þ������Ʒ����������NaCl���������¼�⣺ȡ5��0g��Ʒ����һ������ˮ�еõ�25��0g��Һ���ټ���������������Ϊ10%������������Һ��ʵ��ʱ�õ����������������NaOH��Һ��������ϵ��ͼ��ʾ���������M��ʱ������Һ���������������������ȷ��0��1%����
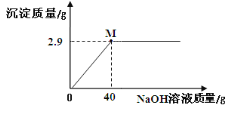
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������̽���������ش�����
��1��̽�����������ʣ�
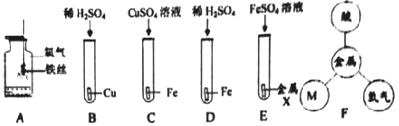
��ͼA�м���ƿ�ڷ�����ˮ��Ŀ��____��C�з�Ӧ������Ϊ____��D�еķ�Ӧ����__(�������Ӧ���ͣ�
��ΧB��E��ֻ��B����Ӧ����ʵ�ɵó���Ԫ�������ֽ����������ɻn���õ�˳����_______
��ͼF�е�M��_______(��������𣩡�
��2����ʶ�������Ʊ�����һ����̼��ԭ������(��Ҫ�ɷ�Ϊ�⻯�����Ļ�ѧ����ʽΪ____.
��3�����շ�Һ�н�����ij���ų��ķ�Һ��Ҫ��Zn(NO3)2��AgNO3,Ϊ��H����}Ag��Zn��NO3��2,ijͬѧ���������ʵ��
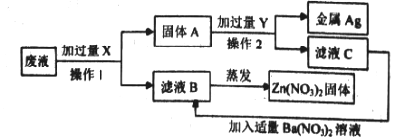
�ٲ���I��������__________,�������X��Ŀ����__________,
����ҺC����Ҫ�ɷ���__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7�֣���5%��NaOH��Һ��μ��뵽109ϡ�����У��ӱ߽��裬����NaOH��Һ�ļ��룬��ҺpH�ı仯��ͼ��ʾ��
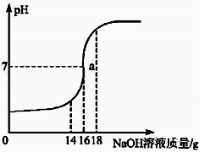
�Իش�
��1��a����Һ�д������ڵ������� ��
��2����ǡ����ȫ��Ӧʱ������NaOH��Һ������Ϊ ��
��3������ϡ���������ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)ʵ��������100g 10%���Ȼ�����Һʱ����Ҫ________g�Ȼ��ƹ��塣������Ʒʱ��Ӧ����Ʒ����������ƽ��_________���
�ٳ���ʱ���������Ϊ23.1g���ձ�ʢ�Ź��壬��������ƽ���ѷ�30g�����룬����ƽ�ϵ�����λ��Ӧ����ͼ��_____________(����ĸ)��
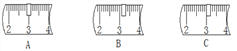
�����������У���ȡˮʱ��Ҫ�õ�d��____����(�����)���ܽ�ʱ��Ҫ�õ�e��____����(�����)��(ÿ��1��)
a���ձ���b��10mL��Ͳ��c��100mL��Ͳ��d���ιܡ�e����������f��ҩ�ס�g��������
��Ϊ�ӿ�ʳ�ε��ܽ��ٶȣ����Բ��õķ����У�_________________������Ƶ���Һ������������������10��������Ϊ����ԭ����____________ ��(��дһ��)��
(2)�ڴ����ᴿ�У����Ȼ�����Һ�������н϶�������������Ӧ_____��_____���������Ƚ�������Һ�������ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��̽����ѧϰ��ѧ����Ҫ������
(1)��ѧ��ȤС���ͬѧ������п�����뵽Ũ����a��.�����д��������ݷų������nj�����ijɷֽ�����̽����
��������⡿п������Ũ��������ɵ�������ʲô��
���������ϡ���Ũ��������п��Ӧ����������������Ҳ�������������
��SO2�д̼�����ζ��������ˮ����ʹƷ�죨һ�ֺ�ɫɫ�أ���Һ��ɫ��
��������롿�ף�������H2���ң�������SO2������������SO2��H2��
��ʵ��̽����Ϊ����֤�������롣ͬѧ������ʦ��ָ�������������ͼ��װ�ã����ּг�������ȥ������ÿ���ܷ����ķ�Ӧ����ȫ���У�����̽����
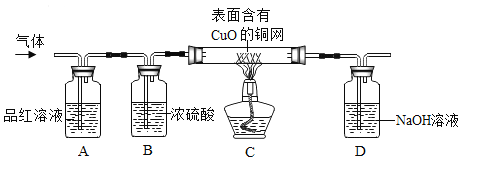
��ʵ�鿪ʼ�۲쵽A��Ʒ����Һ��ɫ��֤�������к���____��
��Bװ�õ�������____��
��Cװ���ڵ�ȼ�ƾ��Ƽ���֮ǰӦ��ͨһ��ʱ������壬Ŀ����__������һ��ʱ��۲쵽_____��֤�������к���H2��
�����ۡ�
��п��Ũ���ᷴӦ��������п��ˮ�Ͷ�������Ϊʲô�ڷ�Ӧ�������ֲ����������أ������ּ���ԭ��____��
��п��Ũ�����ϡ���ᷴӦ�����Բ�������п�������Ҫ��ȡ����п����п��ϡ���ᷴӦ���ŵ���____������һ�ֺ����Ĵ𰸣���
(2)̼�����ƣ�NaHCO3���׳���С�մ���������������;�㷺��ij��ѧʵ��С���ͬѧ��̼�����Ƶ����ʽ���̽����
��̽��ʵ��1��̼��������Һ�������
���Թ�ȡ����̼��������Һ���μӷ�̪��Һ������Һ��dz��ɫ�����ۣ�____��
��̽��ʵ��2�������ᷴӦ
ȡ����̼�����Ƽ����Թ��У��μ�ϡ���ᣬ�ٰ�ȼ�ŵ�ľ��Ѹ�������Թܣ�ľ��Ϩ��̼�����ƺ�����Ļ�ѧ��Ӧ����ʽ��____��
��̽��ʵ��3������Ӧ
�������ϣ�NaHCO3+NaOH�TNa2CO3+H2O��������������ˮ�����Թ�ȡ����̼��������Һ���μ�����������Һ��������������ʾ������ѡ��CaCl2��Һ���Լ���ͨ��֤����Na2CO3���ɣ��Ӷ�֤�����߷����˷�Ӧ����ͼ����λͬѧ�ֱ�����˼ס�������ʵ�飮�ش��������⣺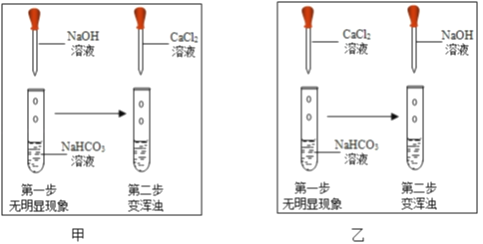
�Ƚϼס�������ʵ���Ŀ����������____��
��ͬѧ�������ʵ�鶼������֤����Na2CO3���ɣ���������____��Ҫ֤����Na2CO3���ɣ�����Ҫ���еIJ�����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼʾ��A����F�dz��л�ѧ���������ʡ������ʡ�������ᡢ��η��࣬A��B��C��D��E�����ֲ�ͬ�������ʣ�F�Ǵ���ʯ����Ҫ�ɷ֡�ͼ����--����ʾ��������������֮����Է�����Ӧ����������ʾ���ʼ��������Ӧ��ת����ϵ(���ַ�Ӧ������P��Ӧ��������ȥ)����ش�
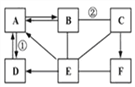
(1)����F�Ļ�ѧʽ__________��
(2)��Ӧ�ڵĻ�ѧ����ʽ____________________��
(3)��Ӧ�ٵĻ�����Ӧ������_____________��
(4)E��������Ԫ����ɵģ���д�����һ����;_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com