
【题目】某工厂排放的工业废水中含有硫酸亚铁和少量硫酸铜。下图是从该废水中回收金属铜和硫酸亚铁晶体的主要流程,请回答下列问题:

(1)工业废水中加入铁粉后发生反应的化学方程式为______________。
(2)操作I名称为______________。
(3)进行操作I前加入稀硫酸的目的是___,能否用稀盐酸代替?_______(填“能”或“不能”),原因是______________。
(4)实验室稀释浓硫酸的具体操作为______________。
【答案】![]() 过滤 除去铜中过量的铁粉 不能 因为这样会生成氯化亚铁使硫酸亚铁不纯净 将浓硫酸酸缓慢沿内壁倒入水中,并不断搅拌
过滤 除去铜中过量的铁粉 不能 因为这样会生成氯化亚铁使硫酸亚铁不纯净 将浓硫酸酸缓慢沿内壁倒入水中,并不断搅拌
【解析】
(1)工业废水中含有硫酸亚铁和少量硫酸铜,按照流程加入铁粉后,铁粉会与硫酸铜生成硫酸亚铁和铜,反应方程式:![]() ;
;
(2)操作一之后形成了固体和溶液,分离固体和溶液的方法是过滤;
(3)因工业废水中加了过量铁粉,因此得到的固体中有铜和过量的铁,加入稀硫酸的目的是为了将铜中的铁粉除去,生成硫酸亚铁,提高硫酸亚铁的回收率;
(4)铁和盐酸反应会生成氯化亚铁,而该流程是为了回收硫酸亚铁晶体,若生成氯化亚铁则会导致硫酸亚铁不纯,故不能用稀盐酸代替稀硫酸;
(5)浓硫酸的稀释需要将浓硫酸酸缓慢沿内壁倒入水中,并不断搅拌防止局部温度过高沸腾;
故答案为:![]() ;过滤;除去铜中过量的铁粉;不能;因为这样会生成氯化亚铁使硫酸亚铁不纯净;将浓硫酸酸缓慢沿内壁倒入水中,并不断搅拌。
;过滤;除去铜中过量的铁粉;不能;因为这样会生成氯化亚铁使硫酸亚铁不纯净;将浓硫酸酸缓慢沿内壁倒入水中,并不断搅拌。


科目:初中化学 来源: 题型:
【题目】![]() 表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,他们之间的转化关系如图所示
表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,他们之间的转化关系如图所示![]() 反应条件,部分反应物及生成物已略去
反应条件,部分反应物及生成物已略去![]() ,请回答下列问题:
,请回答下列问题:

(1)A的化学式为______。
(2)B的一种用途是______。
(3)反应![]() 的化学方程式为:______。
的化学方程式为:______。
(4)E、F、G三种金属的活动性由强到弱的顺序为______。
(5)写出一个符合题中要求的反应![]() 的化学方程式______。
的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液与人们的生产生活密切相关。
(1)下列有关溶液的说法正确的是________(填字母)。
A均一、稳定的液体都是溶液
B硝酸钾饱和溶液的溶质质量分数大于不饱和溶液的溶质质量分数
C饱和溶液可能是是稀溶液,不饱和溶液可能是浓溶液
(2)向pH=4的稀硫酸中缓慢滴加一定量蒸馏水后,所得溶液的pH可能为_______(填字母)。
A3
B5
C7
D9
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题。

①交点P表示的意义为_______。
②t3℃时,分别取50g甲、乙、丙三种固体物质溶于100g水中,充分溶解后,一定达到饱和溶液的是________(填“甲” “乙”或“丙”)。
③t2℃时将50g甲放入50g水中,所得溶液的溶质质量分数为________(计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知如图A、B、C三种元素的粒子结构示意图依次为:

(1)当A、B为原子结构示意图时,X=_____;Y=_____;
(2)当A为离子结构示意图时,若该离子带2个单位正电荷时,则其离子符号为_____,若该离子带一个单位负电荷时,则其离子符号为_____。
(3)C表示的是离子结构示意图,为_____(填“阳离子”、“阴离子”或“原子”);该元素与B元素形成的化合物的化学式为_____;该化合物是由_____(填“分子”、“原子”或“离子”)构成。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是我们学习化学的重要工具。下图是元素的相关信息,下列有关说法正确的是

A.镧元素属于非金属元素
B.镧原子在化学反应中易失电子
C.镧原子核内有57个中子
D.镧原子的相对原子质量为138.9g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列检验氢氧化钠溶液变质的实验,回答有关问题。
(1)氢氧化钠溶液露置于空气中变质的反应可以用化学方程式表示__。
(2)通过实验检验氢氧化钠溶溶液是否变质;
下列实验中,可判断出其是否变质的是_____。
A 样品+酚酞溶液
B 样品+过量稀盐酸
C 样品+澄清石灰水
D 样品+硝酸钡溶液
(3)通过实验确定氢氧化钠容易的变质程度:
取20g该氢氧化钠溶液,加入过量的氯化钙溶液,共产生沉淀5g,据此计算,该溶液中碳酸钠的质最分数为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用化学用语填空。
(1)2个氯离子__________________。
(2)地壳中质量分数占第二位的元素_______________。
(3)氨气中氮元素的化合价________________________。
(4)铁锈的主要成分______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】十三五期间,烟台将建设大型海水淡化厂,绿色生态、综合利用海洋资源将是设计的重点,如图是某设计院设计的综合利用的海水的流程图,据图回答问题

(1)反渗透膜法与滤纸过滤法在原理上都是利用混合体系中各物质的_______不同进行分离的方法。
(2)过程③是氨碱法制纯碱的一个流程,需要向饱和食盐水中先后加入的两种物质是_______(写化学式),该过程中发生反应的化学方程式是_______,碳酸氢钠在生活中的用途是_______。
(3)过程④采用蒸发结晶的方法,而不采用冷却热饱和溶液方法,原因是_______。
(4)如果要充分利用海边贝壳资源,过程⑤生成氢氧化镁的化学方程式是_______。
(5)浓海水中Mg2+、SO42﹣、Ca2+,可用离子交换膜直接除去,若用化学沉淀法依次除去Mg2+、SO42﹣、Ca2+,需要的三种离子依次是_______(写离子符号)
(6)离子交换膜是对特定离子的选择性透过膜,可以使带特定电量的离子透过,过程②中“某种离子交换膜”选择透过的离子特点是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石灰石高温煅烧获得的生石灰是炼钢生产中的主要碱性造渣材料,其活性度好坏对冶炼过程有重要影响。
(提出问题)哪些因素可能影响生石灰的活性度?
(查阅资料)生石灰活性度体现了生石灰与其他物质的反应能力,是表征生石灰水化反应速度的一个指标。生产中常用的检测标准定义为:在足够时间内,用中和生石灰消化时产生的Ca(OH)2所消耗的盐酸的体积数(单位为mL)表示。
(进行实验)
实验1:相同条件下,煅烧不同石灰石,测生石灰的活性度。
产地 | 石灰石 | 生石灰 | |
外观 | CaO含量/% | 活性度/mL | |
A地 | 灰白色 | 94.89 | 391 |
B地 | 灰白色带少量红棕色 | 89.97 | 375 |
实验2:取某石灰石试样,在电炉内进行煅烧,烧成后测定生石灰的活性度。
时间/min | 各煅烧温度下的生石灰活性度/mL | |||||
1050℃ | 1100℃ | 1150℃ | 1200℃ | 1250℃ | 1300℃ | |
12 | 790 | 836 | 868 | 808 | 454 | 412 |
16 | 793 | 856 | 871 | 845 | 556 | 530 |
20 | 795 | 863 | 873 | 864 | 617 | 623 |
实验3:煅烧温度1050℃时,加NaCl和不加NaCl,比较煅烧石灰石的分解率(分解率影响生石灰活性度)。
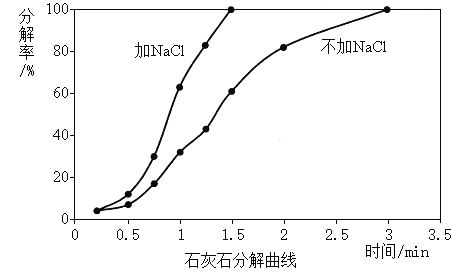
(解释与结论)
(1)实验1的目的是___________。
(2)能证明最佳煅烧温度为1100~1200℃的证据是__________。
(3)实验3的结论是_________。
(反思与评价)
(4)写出石灰石高温分解生成生石灰和另一种氧化物的化学方程式_________。
(5)除以上研究的可能影响生石灰活性度的因素外,你认为还可以研究的其他因素有_______(写出一条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com