
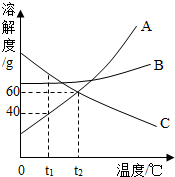
 (1)如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
(1)如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:分析 (1)①根据溶解度曲线可知,温度变化溶液成分的变化情况;
②t2℃时,A的溶解度为60 g,则在该温度下,100 g水中最多溶解60 g A物质恰好形成饱和溶液;
③硝酸铵溶于水时吸收热量,使A物质的溶解度减小,有固体析出;
④C的溶解度随温度升高而减小,所以其饱和溶液变为不饱和溶液可采取加入溶剂、或降温的方法;
(2)根据酸碱度的测定、硬水和软水的鉴别及软化分析解答.
解答 解:(1)①等质量A、B的饱和溶液,当温度从t1℃升高到t2℃后,AB的溶解度均增大,所以溶液中溶质、溶剂的质量不变,故所得溶液质量依然相等;
②t2℃时,A的溶解度为60 g,则在该温度下,100 g水中最多溶解60 g A物质恰好形成饱和溶液;
③室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3并搅拌,试管内可以观察到的现象是有固体析出,因为硝酸铵溶于水温度降低;
④C的溶解度随温度升高而减小,所以其饱和溶液变为不饱和溶液可采取加入溶剂、或降温的方法;
(2)饮用酸碱度过大或硬度过大的水都不利于人体健康,可用 pH试纸测定水的酸碱度,检验水是硬水还是软水,通常可用的物质是肥皂水,泡沫丰富则是软水,浮渣较多则是硬水;生活中使硬水软化常用方法是煮沸;
故答案为:(1)①=;②60;③有固体析出;④降温;(2)pH试纸;肥皂水;煮沸.
点评 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以培养学生应用知识解决问题的能力.


科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙、过滤 |
| B | KOH溶液 | KCl | 适量稀盐酸 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液、过滤 |
| D | FeSO4 | H2SO4 | 氧化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 发明侯氏制碱法的科学家是侯德榜 | |
| B. | 最早用湿法冶金原理炼铜的国家是中国 | |
| C. | 最早通过实验得出空气由氮气和氧气组成的科学家是道尔顿 | |
| D. | 最早发现元素之间存在联系并排列出元素周期表的科学家是门捷列夫 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反 应 物 | 化 学 方 程 式 | |
| 1 | 氢氧化钙与盐酸反应 | Ca(OH)2+2HCl=CaCl2+2H2O |
| 2 | 氢氧化钠与稀硫酸反应 | 2NaOH+H2SO4=Na2SO4+2H2O |
| 3 | 用胃舒平(氢氧化铝)中和过多的胃酸 | Al(OH)3+3HCl=AlCl3+3H2O |
| 4 | 用熟石灰中和含有硫酸的污水 | Ca(OH)2+H2SO4=CaSO4+2H2O |
| 5 | 碳酸氢钠与稀盐酸反应 | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 6 | 用稀盐酸除铁锈 | 6HCl+Fe2O3=2FeCl3+3H2O |
| 7 | 用稀硫酸除铁锈 | 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O |
| 8 | 用碳酸钠制取氢氧化钠 | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
| 9 | 氯化钡与稀硫酸反应 | BaCl2+H2SO4=BaSO4↓+2HCl |
| 10 | 氢氧化钠与三氧化硫反应 | 2NaOH+SO3=Na2SO4+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 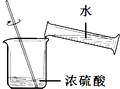 稀释浓硫酸 | B. | 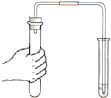 检查装置气密性 | ||
| C. | 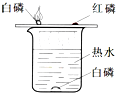 探究可燃物燃烧的条件 | D. | 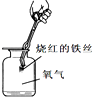 铁丝在氧气中燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
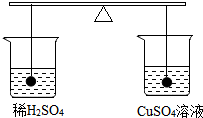 如图所示在大小相同的两只烧杯中各装有等质量的稀硫酸和硫酸铜溶液,然后将等质量的铁、铜分别浸没在硫酸铜溶液和稀硫酸中片刻,下列说法正确的是( )
如图所示在大小相同的两只烧杯中各装有等质量的稀硫酸和硫酸铜溶液,然后将等质量的铁、铜分别浸没在硫酸铜溶液和稀硫酸中片刻,下列说法正确的是( )| A. | 左边烧杯中溶液的质量减轻 | B. | 右边烧杯中溶液的质量减轻 | ||
| C. | 两边烧杯中溶液的质量都减轻 | D. | 片刻后两边仍然平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com