
【题目】A、B、C三种不含结晶水的固体物质的溶解度曲线如右图,下列说法中正确的是
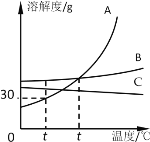
A. t1℃时,三种物质的溶解度大小关系为A>C>B
B. t1℃时,65 g A的饱和溶液中含有15 g A
C. t2℃时,A、B两溶液的溶质质量分数相同
D. B中含有少量杂质A时,可采用降温结晶的方法提纯B
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】现有以下实验装置,按要求回答问题。
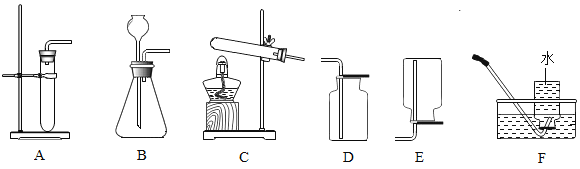
(1)实验室用锌粒和稀硫酸制取氢气,发生装置可选择_______(填编号),收集装置可选择________(填编号)。
(2)若用高锰酸钾制取O2,反应的化学方程式是______,发生装置应选________(填编号),若用装置F收集气体,应等到导管口_____时,才将导管移入集气瓶开始收集气体。
(3)若用100g含杂质5%的石灰石和盐酸制取CO2(杂质不与盐酸反应),反应的化学方程式是___,最多能生成CO2____g。实验时,发生装置最好选____(填编号);若用装置D来收集CO2,验满的操作是:将燃着的木条伸到___观察。
(4)
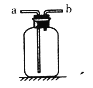
常温常压下,氨(NH3)是一种无色有刺激性的气体,密度比空气小,极易溶于水,广泛应用于化工、轻工等领域。实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,发生装置应选择____(填编号);若用如图装置来收集NH3,则气体应从____(填“a”或“b”)端进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁均为初中化学常见的物质,它们之间的部分转化关系如图所示(部分反应物、生成物和反应条件己略去。“﹣”表示物质之间能发生化学反应,“→”表示物质之间的转化关系)。下列推论不正确的是( )
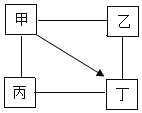
A. 若甲是HCl,则丁可能是CaCl2
B. 若甲是H2SO4,则乙和丙中可能有一种为单质
C. 若甲是Ca(OH)2,则丁可能是NaOH
D. 若甲是Ca(OH)2,则乙和丙中必须有一种为酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是一氧化碳还原氧化铁的实验。
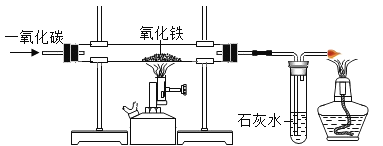
(1)玻璃管中发生的反应是![]() ,该反应利用了CO化学性质中的______性;
,该反应利用了CO化学性质中的______性;
(2)若先给氧化铁加热,再通一氧化碳可能产生的后果是______;
(3)根据石灰水中______现象,可以判断反应是否开始;
(4)右端点燃酒精灯的目的是防止尾气中的______污染空气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在电解水的实验中,为了加快电解的速度,可向水里加入少量H2SO4(已知通电时H2SO4不发生变化)。若水电解装置中盛有4.91%的H2SO4溶液100g,通电一段时间后切断电源,水的质量减少了1.8g。
①计算生成O2的物质的量_________(根据化学方程式列式计算)。
②此时溶液中溶质H2SO4的质量分数为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某综合实践小组用溶质质量分数为10%的稀硫酸,对某造纸厂排放含NaOH的碱性废水进行检测。
(1)用溶质质量分数为98%、密度是1.84 g·mL-1的浓硫酸来配制100 g 10%的稀硫酸。配制的有关步骤依次为计算、____、稀释、转移装瓶、贴上标签。
(2)取含NaOH的碱性废水200 g,置于烧杯中,滴加2~3滴____。再向烧杯中边搅拌边滴加溶质质量分数为10%的稀硫酸39.2 g,反应恰好完全,此时溶液由红色刚好变为____色。计算碱性废水中NaOH的质量分数____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】南京大学课题组研制出ZnGa204,催化材料,实现将CO2转化为碳氢化合物燃料。下图为锌元素在元素周期表中的相关信息及原子结构示意图。下列说法正确的是:
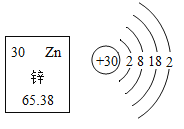
A. 锌属于非金属元素
B. 锌原子的质子数为30
C. 锌的相对原子质量为65.38g
D. 锌原子在化学反应中易失去电子形成Zn+2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
![]()
(提出问题)常温下钠与氧气反应,产物有哪些?
(查阅资料)钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
(作出猜想)常温下钠与氧气反应的产物。
猜想1:Na2O; 猜想2:Na2O2; 猜想3:_______。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | (_____) | 猜想1正确 |
(继续探究)钠在空气中放置一段时间得到白色固体的成分
(作出猜想)猜想一:Na2CO3猜想二:Na2CO3和NaOH
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量_____。 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入酚酞。 | (______) |
(实验反思)
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式_______;
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为______;
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2___碱性氧化物(填“是”或“不是”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:相等。
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转 |
结论 | 猜想1正确反应的化学方程式:_____ | 猜想2正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_____中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是_____ (填序号),从另外两种装置中任选一种指出其不足_____。
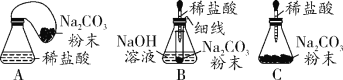
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材参加化学反应和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_______的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_____种元素组成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com