
【题目】某化学课外小组对生活中另外一种常见金属铜在空气中能否生锈进行了以下探究:
[提出问题![]() 铜在空气中长期放置会生锈吗?生锈的条件是什么?
铜在空气中长期放置会生锈吗?生锈的条件是什么?
![]() 查阅资料
查阅资料![]() 铜在朝湿的空气中会慢慢生锈变绿,俗称铜绿,主要成分为碱式碳酸铜,化学式为Cu2(OH)2CO3
铜在朝湿的空气中会慢慢生锈变绿,俗称铜绿,主要成分为碱式碳酸铜,化学式为Cu2(OH)2CO3
![]() 作出猜想
作出猜想![]() (1)小组成员一致认为,铜生锈可能是铜与空气中的氧气、________共同作用的结果,他们猜想的依据是___________________。
(1)小组成员一致认为,铜生锈可能是铜与空气中的氧气、________共同作用的结果,他们猜想的依据是___________________。
![]() 设计实验
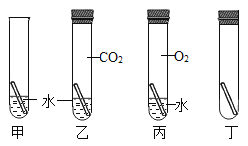
设计实验![]() 同学们设计如图实验,探究铜生锈条件:将完全相同的铜片放入不同环境中,观察生锈情况。
同学们设计如图实验,探究铜生锈条件:将完全相同的铜片放入不同环境中,观察生锈情况。
(2)小组同学讨论认为仅完成甲、乙、丙三个实验不能得出实验结论,于是又用丁试管补充了一个实验,装置中除了铜片外,还应该加入__________。
[观察现象]放置两周后,发现甲中的铜片变绿了,乙丙丁中的铜片没变化。
[得出结论]
(3)甲和乙对比,得出的结论是铜生锈需要与________接触。
(4)甲和丙对比,得出的结论是铜生锈需要与________接触。
(5)写出铜生锈生成碱式碳酸铜的的化学反应方程式是______________________。
[反思拓展]
(6)乙和丙中使用的是煮沸后迅速冷却的蒸馏水,目的是_______________________。
(7)小明发现从不同地点收集到的两个铜器(一个是纯铜做的,一个是青铜做的)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀。小明的分析是否全面?请你说明理由:________________。
【答案】水、二氧化碳 化学变化前后元素种类不变 二氧化碳、氧气 氧气 二氧化碳 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 除去溶解在水中的氧气和二氧化碳 小明的分析不全面;因为两个铜器是从不同地点收集到的,条件不同,无法比较
【解析】
(1)由于铜锈中含有铜、碳、氢、氧,小组成员一致认为,铜生锈可能是铜与空气中的氧气、水、二氧化碳共同作用的结果,他们猜想的依据是化学变化前后元素种类不变;
(2)由甲、乙、丙的探究方法可知,装置丁中除了铜片外,还应该有二氧化碳、氧气;
(3)甲和乙对比可知,变量是氧气,得出的结论是铜生锈与氧气有关;
(4)甲和丙对比,变量是二氧化碳,得出的结论是铜生锈与二氧化碳有关;
(5)由铜生锈的条件可知,铜生锈的化学反应方程式:2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(6)由于气体的溶解度与温度有关,乙和丙中使用的是煮沸后迅速冷却的蒸馏水,原因是除去溶解在水中的氧气和二氧化碳;
(7)小明的分析不全面;因为两个铜器是从不同地点收集到的,条件不同,无法比较。


科目:初中化学 来源: 题型:
【题目】会用化学眼光看物质世界,是学习化学知识后应有的素质.结合下面材料填空.
材料:一氧化碳是一种没有颜色,没有气味的气体,它能够燃烧,燃烧时放出大量的热,火焰呈蓝色.
(1)从化学物质类别看,CO属于_____(填“单质”或“化合物”);
(2)从应用化学用语角度,“CO燃烧”可表示为_____;
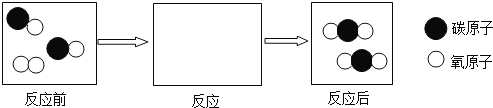
(3)从微观变化角度,“CO燃烧”的微观模型示意图如图所示,请把下图“反应”中的内容补充完整_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是何军同学设计的探究物质燃烧条件的3个对比实验,分析实验:请根据各实验现象,帮助何军同学完成下列实验报告::

步骤 | 设计意图 | 实验现象 | 实验结论 |
实验一 | 燃烧与物质的关系 | ______ | 可燃物才能燃烧 |
实验二 | ______ | 玻璃杯内蜡烛熄灭,外面的仍燃烧 | ______ |
实验三 | 燃烧与温度的关系 | 小木条很快燃烧,小煤块很久才燃烧 | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中A、B分别是某微粒的结构示意图,回答下列问题:
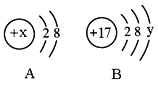
(1)若A是阳离子的结构示意图,则x可能是下列中的______(填字母序号)。
A.8 B.10 C.11 D.12
(2)若B表示某元素的原子,则y=__,该元素的原子在化学反应中容易___(填“失去”或“得到”)电子。
(3)若A中x=13,则A、B所表示的元素形成化合物的化学式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】气体M(含CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法不正确的是( )
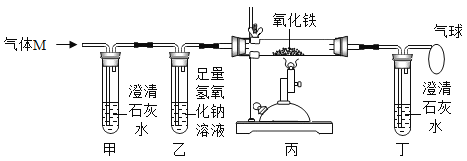
A.若甲中溶液变浑浊,则M中一定含有CO2
B.若撤走丁装置,则无法判断M中是否含有CO
C.必须通入气体一段时间后才能点燃酒精喷灯
D.气球用于收集未完全反应的CO,防止空气污染
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知相同条件下,气体的体积比等于气体的分子个数比。现有20 mLO2、CO和CO2的混合气体,在密闭容器中用电火花引燃,充分反应后恢复到原来状态,体积减少了2 mL,再通过足量澄清石灰水后又减少10mL,最后剩余气体能使带火星的木条复燃。原混合气体中O2、CO和CO2的体积比可能是
A.1:6:3
B.5:2:3
C.3:1:6
D.3:5:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两位同学查阅资料知: CH4 和CO两种气体均具有可燃性和还原性。他们想对CH4的还原性进行研究。
[提出假设]他们对CH4还原CuO的产物提出了以下假设:
假设1: Cu、 CO、CO2
假设2: Cu、 CO、H2O
假设3: Cu、 CO2、 H2O
假设4: Cu、CO、CO2、H2O
其中假设_____不合理, 原因是_____。
[设计实验]为了判断其它几种假设的合理性,他们设计了以下几个实验步骤:
①通入CH4;②停 止通CH4;③点燃酒精灯加热; ④停 止加热;⑤检验甲烷的纯度;⑥继续通入甲烷,直至装置冷却。其合理的操作顺序是(填序号)_____。
[进行实验]
(1)甲同学用以下装置进行定性检验(假设药品都是足量的)。已知:白色的无水硫酸铜粉末遇水变蓝,氢氧化钠溶液可以吸收CO2,浓硫酸可以吸收水蒸气。
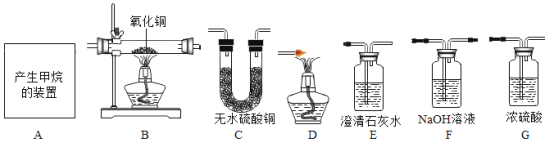
为了尽可能多地检验出CH4还原CuO的产物,则装置正确的连接顺序是(填写字母,装置可重复使用): A→B→_____→_____ →_____→G→B→_____→_____。
(2)乙同学用以下装置进行定量测定(假设药品都是足量的)。实验过程中记录的数据如下。
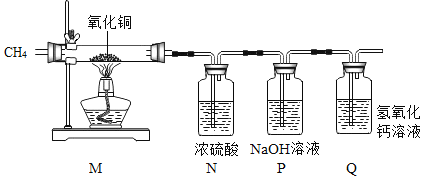
装置序号 | M | N | P |
实验前装置的质量 | 150 | 156.6 | 256.8 |
实验后装置的质量 | 145.6 | 159.3 | 259.0 |
由以上数据可推测,假设_____合理, 化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)用铜制作导线是利用铜的__________性。铁与硫酸铜溶液反应的化学方程式是_____________。
(2)铸造硬币用到Fe、Cu、Ni(镍)等金属,已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=Ni+FeCl2 则Fe、Cu、Ni三种金属活动性由强到弱的顺序为__________(用元素符号表示)。
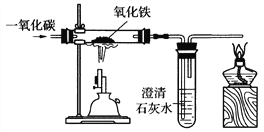
(3)炼铁的原理是利用一氧化碳与氧化铁反应,某同学设计的实验装置如下图:
①实验中玻璃管里的现象是_________,观察到试管里出现的现象是___________。
②该实验要先通CO后加热,目的是___________________。
(4)小强用一定量AgNO3和Cu(NO3)2的混合溶液进行如图实验,并对溶液A和固体B的成分进行分析和研究。
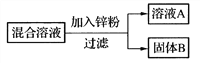
①溶液A中的溶质一定含有______________,可能含有_______________。
②通过以下实验可确定固体B的成分,请将下表填写完整。
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加_________ | 有气泡产生 | 固体B中含有Cu 、Ag和_____ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组用图所示的实验装置,探究影响过氧化氢分解速率的因素。
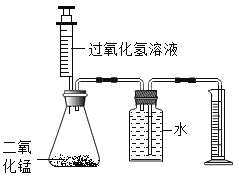
(1)装置中使用注射器的优点是___________________ , 锥形瓶中反应的化学方程式为__________________ 。
(2)下面是用上述装置实验时,收集的相关数据:
实验序号 | H2O2溶液浓度% | 体积ml | MnO2的量/g | 温度/°C | 待测数据 | 反应所需的时间/s |
① | 5 | 2 | 0.1 | 20 | 18 | |
② | 10 | 2 | 0.1 | 20 | 6 | |
③ | 5 | 2 | / | 20 | 64 | |
④ | 5 | 2 | / | 60 | 25 |
(3)从实验①和②对比可知,化学反应速率与__________________有关;从实验__________________对比可知,化学反应速率与是否加MnO2有关。表格中的待测数据那一栏应该是___________________ 。
(4)发现问题:实验温度最难控制,反应一段时间后溶液的温度总是比起始温度高,说明反应__________________ (填“放出”或“吸收”)热量
(5)继续探究:除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法,请写在下面_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com