
【题目】我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
(方案一)样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
实验操作 | 实验现象 | 实验结论 |
取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式: ______________________ |
(2)分析滴加的CaCl2溶液要过量的原因:________________________。
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算出Na2CO3的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为_________。
(方案二)样品与稀硫酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀硫酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好且每步反应或作用都是完全的)。
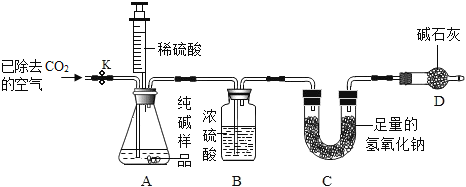
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,再接上装置C和D。其目的是__________________________________________________。
(5)关闭止水夹K,加入足量的稀硫酸(杂质不与稀硫酸反应),装置A中样品产生气体的化学方程式为__________________________________________。该方案中不能用稀盐酸代替稀硫酸的原因是_______________________________________。
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是____________________________________________。根据质量守恒定律,装置_____(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果______(选填“偏大”或“偏小”)。
【答案】Na2CO3+CaCl2═CaCO3↓+2NaCl 与碳酸钠充分反应 不洗涤,碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大,从而导致样品中Na2CO3的质量分数偏大 防止空气中的二氧化碳对实验结果产生影响 Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ 盐酸具有挥发性 使生成的二氧化碳全部被C装置中的氢氧化钠吸收 C 偏大
【解析】
(1)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)滴加的CaCl2溶液要过量的原因与碳酸钠充分反应;
(3)不洗涤,碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大,从而导致样品中Na2CO3的质量分数偏大;
(4)空气中含有二氧化碳,所以打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D;
(5)硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,化学方程式为Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;盐酸具有挥发性,影响实验结果;
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿,目的是使生成的二氧化碳全部被C装置中的氢氧化钠吸收;装置C在反应前后的质量差就是产生CO2的质量;若没有装置D,空气中的二氧化碳会进入氢氧化钠溶液中,将会使测定结果偏大。


科目:初中化学 来源: 题型:
【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
(猜想)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
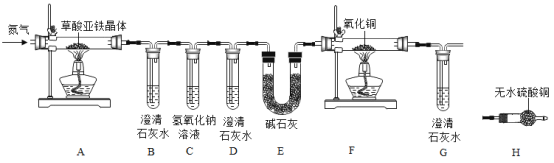
(实验方案)按照上图连接好装置后,加入药品前应该进行的实验操作 (夹持装置未画出) _______(填操作名称)。
(问题讨论)
(1)实验开始前需要先鼓入一段时间的N2 , 该操作的目的为_______
(2) C中氢氧化钠溶液的作用是_______;
(3)(结果分析)定性
①试管B中出现浑浊,证明产物中有_______存在;证明分解产物中存在CO的现象是_______。
②小明认为应增加H装置,则H装置应放在_______两个装置之间,若观察到_______, 则证明有水生成;
(4) (反思评价)从环保角度考虑,该套实验装置的明显缺陷是_______;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料,制备FeCO3和Fe2O3的一种流程如下图所示:
资料:1. FeCO3![]() FeO+ CO2↑ ,4FeO+ O2=2Fe2O3;2.FeSO4+2NH4H CO3= FeCO3↓+( NH4)2 SO4+H2O +CO2↑
FeO+ CO2↑ ,4FeO+ O2=2Fe2O3;2.FeSO4+2NH4H CO3= FeCO3↓+( NH4)2 SO4+H2O +CO2↑

下列说法不正确的是( )
A.反应Ⅰ需控制温度在35℃以下,原因可能是因为NH4HCO3受热易分解
B.滤液中的溶质只有( NH4)2SO4
C.在空气中煅烧23.2g的FeCO3,得到Fe2O3和FeO的混合物15.2g。则生成Fe2O38.0g
D.在空气中充分煅烧FeCO3,若煅烧时间越久,则最终所得固体的质量越多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生命活动和生活中起着十分重要的作用。
(1)生活中可以用_________区分硬水和软水,可以通过________的方法降低水的硬度。
(2)海水中含有大量的氯化钠,可以通过_________方法获得粗盐,可用此方法提纯氯化钠的原因是____________ 。
(3)已知20℃时,氯化钠的溶解度为36g,则用18g氯化钠配制100g氯化钠溶液,所得溶液的浓度为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于四种粒子的结构示意图的说法中正确的是( )
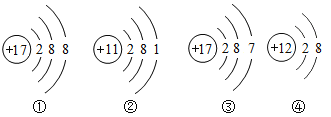
A.①③属于不同种元素B.④属于离子,离子符号为Mg+2
C.②③的化学性质相似D.②表示的元素在化合物中通常显+1价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中,我们会接触到很多的化学物质,请在氮气,碳酸氢钠,氢氧化钠,氧化铁,盐酸,二氧化碳中选择适当的物质的化学式及相应的化学用语填空.
(1)人体胃液中帮助消化的主要物质_____;
(2)用来制作糕点的发酵粉成分之一_____;
(3)写出炉具清洁剂的主要成分中包含的阴离子符号_____;
(4)铁锈的主要成分,并标出其中金属元素的化合价_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

A.若乙固体中含有少量甲,可采用降温结晶的方法提纯乙
B.将甲、乙两种物质的不饱和溶液变为饱和溶液,可以采用相同的方法
C.分别将等量的甲、乙的饱和溶液从 t3℃降温到 t2℃,所得溶液的溶质的质量分数相同
D.用 20%的甲溶液配制 220g 溶质质量分数为 10%的甲的稀溶液,需要加水的质量为 60g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~F是初中化学常见的6种物质,分别由Cu、Ba、Na、H、C、O、S、Cl中的两种或三种元素组成。A的固态可用于人工降雨,C物质含Na元素,E的溶液呈蓝色,E和F反应的生成物为两种沉淀。物质间的关系如图所示(注:图中部分反应物、生成物已忽略,“—”表示反应关系,“→”表示转化关系)。请回答下列问题:
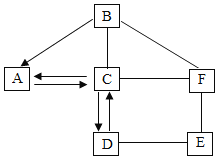
(1)A的固态叫做___________;
(2)B溶液能使紫色石蕊试液变_______色;
(3)写出C、F的化学式:C____________;F___________;
(4)写出D和E反应的化学方程式:________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量![]() 和
和![]() 的混合溶液中逐渐加入足量锌粒,如图是反应过程中氧化亚铁的质量变化情况:
的混合溶液中逐渐加入足量锌粒,如图是反应过程中氧化亚铁的质量变化情况:
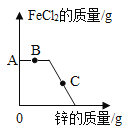
(1)B点时,反应的化学方程式为________;
(2)C点时,溶液中的溶质有________;
(3)C点与A点相比,溶液质量________(填“增加”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com