
【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
(猜想)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
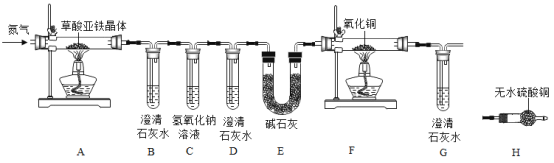
(实验方案)按照上图连接好装置后,加入药品前应该进行的实验操作 (夹持装置未画出) _______(填操作名称)。
(问题讨论)
(1)实验开始前需要先鼓入一段时间的N2 , 该操作的目的为_______
(2) C中氢氧化钠溶液的作用是_______;
(3)(结果分析)定性
①试管B中出现浑浊,证明产物中有_______存在;证明分解产物中存在CO的现象是_______。
②小明认为应增加H装置,则H装置应放在_______两个装置之间,若观察到_______, 则证明有水生成;
(4) (反思评价)从环保角度考虑,该套实验装置的明显缺陷是_______;
【答案】检查装置气密性 通入N2排除装置内的空气,避免空气中CO2对实验造成的干扰 吸收二氧化碳,防止影响CO的检验 CO2 D中澄清石灰水不出现浑浊,G中澄清石灰水出现浑浊(F内固体变红) AB 白色粉末变蓝 没有吸收尾气中的一氧化碳,对空气可能造成污染
【解析】
(1)加入药品前,应该进行的实验操作是检验装置气密性,故填写:检查装置气密性;
(2)分析装置图可知,通入氮气提供惰性环境,避免干扰分解产物的分析和验证,故填写:通入N2排除装置内的空气,避免空气中CO2对实验造成的干扰;
(3)C中盛放氢氧化钠溶液,吸收二氧化碳,防止影响CO的检验,故填写:吸收二氧化碳,防止影响CO的检验;
(4)B中是澄清石灰水,生成沉淀证明产生的气体中有二氧化碳,故填写:CO2;
证明产生气体中有一氧化碳可以利用装置D中澄清石灰水不变浑浊,一氧化碳还原氧化铜反应生成二氧化碳通过G中澄清石灰水变浑浊,同时,F内黑色粉末变红,故填写:D中澄清石灰水不出现浑浊,G中澄清石灰水出现浑浊(F内固体变红);
结晶水合物分解生成水蒸气,在AB间加一个能够检验水蒸气的无水硫酸铜的干燥管证明水蒸气的生成,故填写:AB;
白色无水硫酸铜粉末遇水会变为蓝色五水硫酸铜,故填写:白色粉末变蓝;
(5)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体,一氧化碳会污染空气,故填写:没有吸收尾气中的一氧化碳,对空气可能造成污染。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】(4分)乙炔(![]() )是生产聚氯乙烯的重要原料。用电石(主要成分为
)是生产聚氯乙烯的重要原料。用电石(主要成分为![]() )与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙
)与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙![]() ,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
(1)乙炔中碳、氢元素的质量比为 。
(2)100kg上述电石渣中氢氧化钙的质量为 ![]() 。
。
(3)用上述电石渣处理含硫酸![]() 的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示是KNO3和NaNO3的溶解度曲线。下列说法正确的是

A.t1℃时,两种溶液中溶质质量分数一定不相等
B.t1℃时,在50g水里加入15g KNO3固体,充分溶解,得到60g溶液
C.t1℃时,硝酸钾、硝酸钠两物质饱和溶液升温到t2℃后,溶质质量分数相等
D.两种饱和溶液从t2℃降温到t1℃时,析出晶体:硝酸钾一定多于硝酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空:
①2个氢原子__________;
②氖气___________;
③水中氧元素为﹣2价____________;
④4个氢氧根离子______________;
⑤地壳中含量最多的金属元素:____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
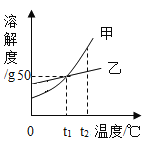
A.t1℃时,甲、乙两种物质的溶解度都是50g
B.t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙
C.t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小.
D.t1℃时,将30g甲放到50g水中,所得溶液的溶质质量分数约为33.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与我们的生活有着密切联系。
(1)洋葱中含有一种具有强烈刺激性气味的物质硫化丙烯(C3H6S)。切洋葱时,会流眼泪,从分子的角度应解释为___________。
(2)微量元素在人体中的含量虽然很少,但对人体却有非常重要的作用。人体缺______就会引起甲状腺肿大。
(3)农村一些家庭用“沼气”作燃料,沼气的主要成分是甲烷,请写出甲烷完全燃烧的化学方程式___________
(4)用洗涤剂除去油污,是利用洗涤剂的_________作用。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与人类的生产、生活密切相关。
(1)化学与健康。
钙能强壮骨骼,在人体中属于_____________(填“常量元素”或“微量元素”)。
在人体组织中,葡萄糖(C6H12O6)在酶的催化作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,该反应的方程式为_______________________________________。
(2)化学与资源。
在空气成分中,稀有气体所占比率虽然很小,但有广泛的用途。写出氦气的化学式,并标出氦元素的化合价:_______。
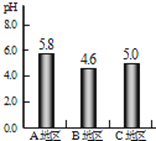
降雨是自然界中水循环的一个环节。正常的雨水略呈______性(填“酸”或“碱”),是由于_________________________(填化学方程式),酸雨是由于SO2等气体或这些气体在空气中反应后的生成物溶于雨水所形成。A、B、C三个地区雨水的pH如图所示,其中________地区的雨水是酸雨。
(3)化学与材料。智能手机是一种多功能通信工具,一款智能手机通常含有41种以上化学元素,请回答:
大部分手机外壳是用塑料或镁合金制成,二者属于高分子合成材料的是___________。
手机线路的主要原料是铜,微电子材料还用到金、银、钽等,在此主要利用了铜的______性。
手机屏幕大部分用的是硅酸铝玻璃,下列关于硅酸铝玻璃性质的推测不正确的是_____(填序号)。
a.透光性好 b.常温下不易与氧气反应 c.易溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在工业上,精炼铜、镀铜以及制造各种铜的化合物时,都要应用硫酸铜.某工广用硫化铜![]() 为原料制备硫酸铜,拟选择以下两个方案:
为原料制备硫酸铜,拟选择以下两个方案:
[方案一]硫化铜在催化剂的作用下跟空气中的氧气发生化合反应,生成硫酸铜.
[方案二]![]() ,
,![]() .
.
(1)请写出方案一反应的化学方程式:______.
(2)从环境保护的角度考虑,两个方案中______(填“方案一”或“方案二”)更合适,理由是______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
(方案一)样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
实验操作 | 实验现象 | 实验结论 |
取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式: ______________________ |
(2)分析滴加的CaCl2溶液要过量的原因:________________________。
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算出Na2CO3的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为_________。
(方案二)样品与稀硫酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀硫酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好且每步反应或作用都是完全的)。
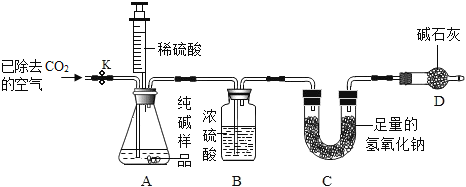
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,再接上装置C和D。其目的是__________________________________________________。
(5)关闭止水夹K,加入足量的稀硫酸(杂质不与稀硫酸反应),装置A中样品产生气体的化学方程式为__________________________________________。该方案中不能用稀盐酸代替稀硫酸的原因是_______________________________________。
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是____________________________________________。根据质量守恒定律,装置_____(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果______(选填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com