
【题目】用化学用语填空:
①2个氢原子__________;
②氖气___________;
③水中氧元素为﹣2价____________;
④4个氢氧根离子______________;
⑤地壳中含量最多的金属元素:____________.
【答案】2H Ne ![]() 4OH﹣ Al
4OH﹣ Al
【解析】
解:①子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氢原子可表示为:2H;
②氖气是一种稀有气体单质,由原子直接构成的,其化学式用元素符号来表示,故填:Ne;
③由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故水中氧元素为﹣2价可表示为![]() ;
;
④离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故4个氢氧根离子表示为4OH﹣;
⑤地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,其元素符号为:Al。


科目:初中化学 来源: 题型:
【题目】已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、E、F 三种物质含有同种非金属元素,其中E与血红蛋白的结合力大约是氧气的200~300倍,F是单质。将A高温煅烧,得到B与D,它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答:
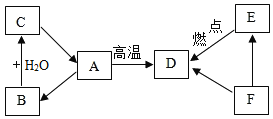
(1)B的化学式为_____;
(2)C在工农业生产、生活中的主要用途有(写出一条)_____;
(3)D+F→E的化学方程式:_____,此反应的类型为_____;
(4)正是因为大气中有D等气体的存在所引起的_____,使得全球平均地表温度提高到适合人类生存的15℃。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
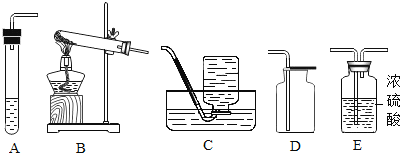
(1)甲同学将课本的基础知识进行整理如上图,请你帮助他完成相关内容.
制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | _________ | ________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是_________(填序号).
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
操作现象 | 结论 | |
① | 取适量生成物置于试管中, 。 | 生成物中不含碳酸镁。 |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, 观察到 现象。 | 生成物中不含氢氧化镁。 |
;(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 。
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
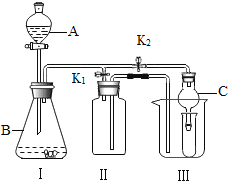
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 ,碳元素的质量分数为 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为 ,装置C的作用为 。判断样品完全反应的方法:当观察到装置B中 ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。 (3分)
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是 。
②分析图像数据判定该说法是 (填“真的”或“假的”),判定理由是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“化学﹣我们的生活,我们的未来”
(1)“化学使天更蓝,水更清.”汽车尾气处理装置能使某些有毒气体转化为无毒气体:2NO+2CO→N2+2CO2.该反应涉及的物质中,_____在空气中含量最高,_____是光合作用的原料,能与血红蛋白结合的是_____.竹子可加工成具有吸附作用的物质,其作用与实验室中常用的_____(填物质名称)相似.
(2)“化学为人类提供动力.”氢能属于绿色能源,氢气燃烧的化学方程式是_____.可燃冰是一种新型能源,在我国南海储量很高.其主要成分为甲烷(CH4),甲烷属于_____(填“无机物”或“有机物”).它燃烧的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示的装置测定空气中氧气的含量,请回答下列问题:
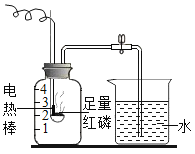
(1)装置中电热棒的作用是__________;
(2)红磷燃烧一段时间后,自动熄灭了,你认为原因是__________;红磷燃烧的化学方程式__________;
(3)足量红磷充分燃烧后冷却至室温,打开止水夹,观察到水沿导管进入集气瓶,水进入集气瓶其原因是__________;进入集气瓶的水约为集气瓶容积的五分之一,由此你得出的结论是__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
(猜想)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
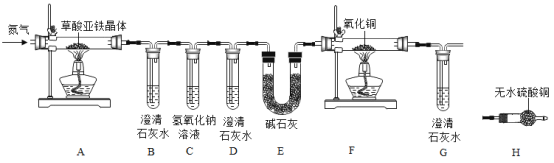
(实验方案)按照上图连接好装置后,加入药品前应该进行的实验操作 (夹持装置未画出) _______(填操作名称)。
(问题讨论)
(1)实验开始前需要先鼓入一段时间的N2 , 该操作的目的为_______
(2) C中氢氧化钠溶液的作用是_______;
(3)(结果分析)定性
①试管B中出现浑浊,证明产物中有_______存在;证明分解产物中存在CO的现象是_______。
②小明认为应增加H装置,则H装置应放在_______两个装置之间,若观察到_______, 则证明有水生成;
(4) (反思评价)从环保角度考虑,该套实验装置的明显缺陷是_______;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“氧泡泡”系列产品去污能力强、绿色环保,其主要成分是过碳酸钠(2Na2CO33H2O2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
(查阅资料)
Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;
Ⅱ.过碳酸钠与盐酸反应:2(2Na2CO33H2O2)+8HCl═8NaCl+4CO2↑+3O2↑+10H2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放处的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(1)20℃时测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈_______(选填“酸性”、“碱性”或“中性”)。
(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_______。
(3)为测定某“氧泡泡”样品中“活性氧”的含量,取20g样品按如图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与盐酸反应,装置气密性良好)。
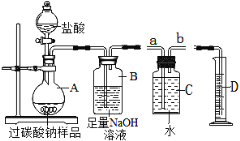
①将盐酸慢慢地滴入A中,反应一段时间后,观察到________时,停止滴加盐酸。
②装置B可吸收生成的CO2,该反应的化学方程式是_____________________________________。
③某同学想用C与D装置收集氧气并测量O2的体积,则 B装置需连接C装置的___端(填“a”或“b”)。
如图所示,将反应后A中所得溶液经过一系列操作,得到固体NaCl的质量为11.7g,请据此计算出该过碳酸钠样品的“活性氧”含量(写出其计算过程)。_______________
提示:过碳酸钠样品中“活性氧”含量可按如下公式计算:
“活性氧”含量=![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生命活动和生活中起着十分重要的作用。
(1)生活中可以用_________区分硬水和软水,可以通过________的方法降低水的硬度。
(2)海水中含有大量的氯化钠,可以通过_________方法获得粗盐,可用此方法提纯氯化钠的原因是____________ 。
(3)已知20℃时,氯化钠的溶解度为36g,则用18g氯化钠配制100g氯化钠溶液,所得溶液的浓度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com