
科目: 来源: 题型:
【题目】推断题:A为黑色固体,A、C、D、Y都是氧化物, F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系.请回答:
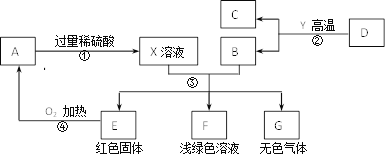
(1)红色的固体E是(写化学式,下同)________ , X溶液中所含有的溶质为_________ ,固体A的化学式为__________,F溶液显浅绿色,其中所含有的溶质是_______。
(2) 写出反应③中生成无色气体的化学方程式__________________________________,
(3) 指出物质G和A在加热条件下发生的化学反应的基本反应类型____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图a、b、c是三种固体物质的溶解度曲线.

(1)物质c的溶解度随温度的升高而 ;
(2)物质a的溶解度大于物质c的溶解度的温度范围是 ;
(3)t2℃时,用50g水配制物质a的饱和度溶液,至少需要 g物质a;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃(溶剂量不变),溶液中的溶质质量分数不变的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某纯碱产品中含有氯化钠杂质。为测定产品中碳酸钠的质量分数,在20℃时,称取该样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图。求:
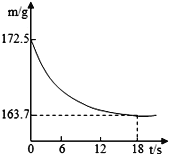
(1)生成CO2的质量__________。
(2)该纯碱样品中Na2CO3的质量分数__________。
(3)完全反应后所得溶液的溶质质量分数___________。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某兴趣小组准备通过锌与稀硫酸反应产生的氢气来测定稀硫酸中溶质的质量分数,装置如下:
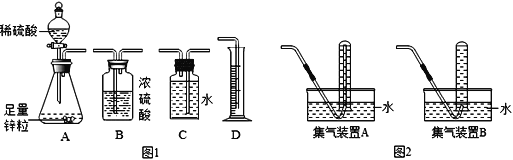
①小明同学用如图1所示装置进行实验,你认为他应该选择的最简易的装置及其连接顺序是:A→______→ D。
②小明若用图2装置收集氢气,应选择集气装置____(填“A”或“B”),为保证测量结果的准确性,收集气体的时机是_________。
a.导管口还没有气泡产生时
b.导管口连续均匀冒出气泡时
c.导管口冒出气泡很多时
③小张同学用如图3所示装置进行了实验:
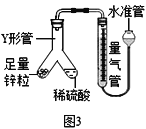
Ⅰ.下列能说明装置气密性良好的是_________。
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平。
Ⅱ.反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐渐减小的原因是_________________(排除仪器和实验操作的影响因素)。
Ⅲ.若实验中测得稀硫酸的溶质质量分数偏大,下列可能的原因是____________。
a.装置漏气 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
(2)在金属活动性顺序表中,排在前面的金属能把位于后面的金属从它的盐溶液中置换出来,但小明在做金属钠与硫酸铜溶液反应的实验时,却出现了异常现象。
【进行实验】取一块绿豆大小的金属钠,放入盛有20毫升硫酸铜溶液的小烧杯中,发现金属钠浮在液面上不停打转,产生大量气体,烧杯发烫,溶液中出现了蓝色絮状沉淀,一会儿部分沉淀渐渐变黑,将反应后烧杯中的混合物进行过滤,得滤渣和无色滤液。
【提出问题】①生成的气体是什么?
②滤渣的成分是什么?
③无色滤液中的溶质是什么?
【查阅资料】①钠能与水反应生成一种碱,同时放出气体。
②氢氧化铜受热至60~80℃变暗,温度再高分解为相应的金属氧化物(化合价不变)和水。
【实验探究一】 探究生成的气体是什么?
小明将上述实验药品放入锥形瓶中,立即塞上带导管的单孔塞,把气体通入肥皂水中,将燃着的木条靠近飘起的肥皂泡,有爆鸣声。说明生成的气体是___________。
【实验探究二】 探究滤渣的成分是什么?
【猜想假设】滤渣中含有Cu(OH)2和_____________,还可能含有Cu。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量滤渣,向其中加入足量的稀硫酸 | ____________________ | 滤渣中没有Cu |
【实验结论】通过实验,小明同学得出结论:钠加入到硫酸铜溶液中会先与水反应,生成物再与硫酸铜反应生成氢氧化铜。请写出上述发生的两个反应的化学方程式______________ ,________________。
【实验探究三】探究无色滤液的溶质是什么?
【猜想假设】猜想① Na2SO4 , 猜想②________________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量无色滤液,向其中加入__________ | 无明显变化 | 猜想①成立 |
【反思交流】钠加入硫酸铜溶液中出现黑色物质的可能原因是(用化学方程式表示)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图1是元素周期表中的一部分,图2是铜原子的结构示意图。据图回答:
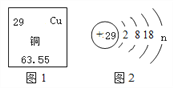
①图2中n的值为____;铜元素位于元素周期表中的第____周期。
②古代青铜器工艺精湛,但出土的青铜器表面大都锈蚀,锈蚀部分存在CuCl,CuCl的化学名称为________,为防止出土的青铜器再锈蚀,文物工作者将糊状Ag2O涂在被腐蚀部位,Ag2O与CuCl发生复分解反应,可以防止青铜器进一步被腐蚀,写出该反应的化学方程式_______。某新出土的青铜器通过分析测得Sn、Pb的质量分别为119 g、20.7 g,则该青铜器中Sn和Pb原子的数目之比为__。
(2)二氧化氯(ClO2)是一种高效净水剂。以粗盐为原料生产ClO2的工艺主要包括:A. 粗盐精制;B. 特殊条件下电解NaCl溶液制NaClO3;C. ClO2的制取。工艺流程如图。
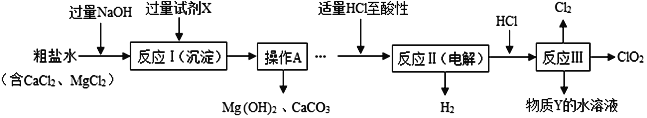 (其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O)
(其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O)
①试剂X中溶质的化学式为________________;操作A名称_____________。
②分析完成反应Ⅱ的化学方程式:_______________________________。
③我国最近已研究出ClO2的新制法,其反应的微观过程如图所示:
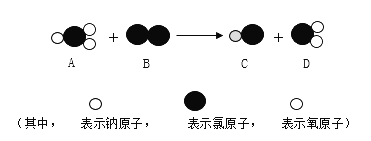
该反应的化学方程式是___________________;该反应中,反应物和生成物所属物质类别有________类。
(3)下图中A~H是初中化学常见的物质。B是最常用的溶剂,E有很好的抗腐蚀性能;D、E、F、H是四种不同类别的物质,且均含有地壳中含量最高的金属元素;四个虚线圈中的反应各属于四个不同的基本反应类型。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
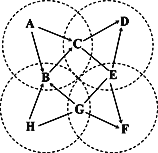
①写出H的化学式:___________。
②写出相关的反应的化学方程式:A→C:_____________; E—G:______________。
③G中一定含有(填元素符号)_______元素。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硝酸钾在不同温度下的溶解度如下表:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
甲是80℃含有100 g水的KNO3溶液,操作过程如下图所示。以下分析错误的是
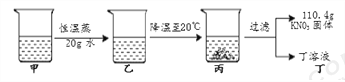
A. 甲、乙、丙、丁四种溶液中,饱和溶液只有2种
B. 甲到乙的过程中,溶质质量没有改变
C. 甲溶液中,溶剂与溶质的质量比为25: 34
D. 甲溶液冷却时,开始析出固体的温度在60℃~70℃之间
查看答案和解析>>
科目: 来源: 题型:
【题目】观察实验图像,得到结论正确的是
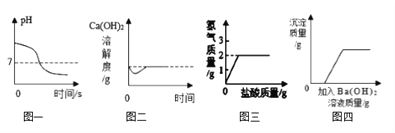
A. 图一:向一定量的氢氧化钠溶液中不断滴加水
B. 图二:向饱和石灰水中加入少量的CaO
C. 图三:在100g Cu-Zn合金中加入足量盐酸,根据氢气质量可知Zn的质量分数为50%
D. 图四:向硝酸和硫酸铜的混合溶液中滴加氢氧化钡溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述、对应的化学方程式和所属反应类型正确的是
A. 拉瓦锡研究空气成分 2HgO =2Hg+O2↑ 分解反应
B. 探究一氧化碳的还原性 CO+CuO![]() Cu+CO2 置换反应
Cu+CO2 置换反应
C. 用二氧化碳制作碳酸饮料 CO2↑ + H2O ═ H2CO3 化合反应
D. 用含小苏打的药物治疗胃酸过多 NaHCO3+HCl═NaCl+H2O+ CO2↑ 复分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上处理40t含硫酸铜的炼铜厂废水,共消耗8t含5%氢氧化钠的造纸厂废水,请回答下列问题:
(1)8t造纸厂废水中含有的氢氧化钠质量为______________。
(2)计算炼铜厂废水中硫酸铜的质量分数______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应后试管中的溶液出现分层现象:

【实验现象】
时间 | 观察现象 |
3min | 铝条表面有红色固体出现,铝条所在位置及其上方溶液颜色逐渐变浅,下方溶液没有变化 |
0.5h | 铝条表面聚集大量红色物质,铝条周围溶液呈无色透明,下方溶液仍为蓝色,无色溶液和蓝色溶液界面清晰 |
(1)写出铝和硫酸铜溶液反应的化学方程式___________________。
(2)实验前打磨铝条并将其绕成螺旋状的目的分别是_______________、_______________
(3)根据实验现象判断,铜与铝的金属活动性关系为___________________。
(4)根据反应后明显分层的溶液判断,生成的硫酸铝溶液密度_______(填“>”或“=”或“<”)原硫酸铜溶液密度,根据反应前后物质质量的关系分析,导致这种结果的原因可能是_______________。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(5)为促进铝与硫酸铜溶液反应,在配制硫酸铜溶液时加入少量NaCl。
【提出问题】为什么在硫酸铜溶液中加入NaCl,有利于铝与硫酸铜溶液反应?
【提出假设】Cl的存在有利于铝与硫酸铜溶液反应。
【设计实验】请你设计一个合理的实验验证该假设_______________________________。
除以上方案外,你还能想到的另一种方案是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com