
科目: 来源: 题型:
【题目】为测定某部分变质氢氧化钠固体中氢氧化钠的含量,研究性学习小组称取42.4g干燥的圆体样品并将其配制成1000mL溶液,分别取出100mL溶液用2种方法进行了测定。
方法1:向100mL样品中加入过量的浓盐酸,并用足量氢氧化钠溶液吸收产生的气体,称得浓氢氧化钠溶液增加了1.10g
方法2:向100mL样品中加入过量BaCl2液,经过滤、洗涤、干燥等操作,分离出反应生成的沉淀物,称得其质量为3.94g
(1)请选用合理方法采集的数据求解固体中氢氧化钠的质量分数为________。(写出计算过程)
(2)向上述用剩的溶液中加入________gBa(OH)2固体,过滤,则可获得纯净的氢氧化钠溶液。(结果保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是“研究燃烧条件”的实验装置,请回答实验内容中的相关问题:
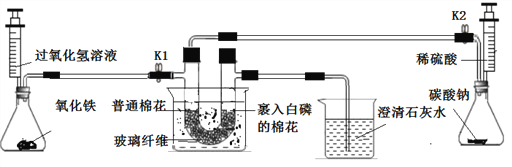
实验准备:连接仪器,______,将充足的药品装入装置A、B、C、D中,盛装氧化铁的玻璃仪器名称为______
实验步骤1:将U形管放入冰水中,打开K1,关闭K2,向U形管充入氧气,两端的棉花都没有燃烧。此时装置A中发生的化学反应方程式为________________。
实验步骤2:关闭K1,打开K2,先从U形管左端通入气体,待观察到表明氧气已排尽,再将U形管放入的80℃的热水中,此时两端棉花也都没有燃烧。表明氧气已排尽的实验现象是______________,产生该现象的化学反应方程式为_________________。
实验步骤3:打开K1,关闭K2,从U形管左端通入氧气。右端裹入白磷的疏松棉花团先冒白烟,片刻后棉花开始燃烧,左端的棉花团仍然没有发生变化。实验步骤1和实验步骤3中对比研究的变量是________。白磷燃烧过程中伴随的能量变化是:_____________。
实验步骤4:在步骤3棉花燃烧的过程中, ____________________(填具体操作和实验现象)。该步骤也能说明燃烧需要氧气,同时说明二氧化碳具有________________________的性质。
实验推算:若以上实验中共需要使用330mL二氧化碳(已知:二氧化碳的密度为2g/L),则实验前至少需要向装置D中加入________g(结果保留2位小数)碳酸钠钠固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】请结合所学化学知识回答以下问题:
(1)下图为中国自主研制的新一代战斗机,其中机翼前后缘采用了玻璃纤维增强塑料(玻璃钢),机轮由轮毂和轮胎组成,驾驶座盖和挡风玻璃采用了两烯酸酯透明塑料,其中玻璃纤维增强塑料属于____(填字母)

a.金属材料 b.合成材料 C.复合材料
(2)现代喷气式战斗机所用燃料是航空煤油。加热炼制_______(填1种化石燃料名称).可以获得航空煤油等不同的产品,不同类型的发动机选用的燃料不同,氢动汽车采用氢气作燃燃料,目前在生活中大量使用氢能源还存在诸多围难(如,制氢成本高)。在实验室里,制取氢气的化学反应方程式为________。
(3)为保障飞行员的健康体魄,后勤部门为他们提供的主食是易于消化的面包、米饭等食物,这些食物中富含________(填1种基本营养素),同时建议他们平时多饮用富硒茶水,属于人体必需的______(填“微量”或“常量”)元素。
(4)新一代战斗机机翼翼梁采用了特种合金,工业上生产该合金的反应为:TiCl4+2Mg高温Ti+2MgCl2,该反应中_________(填微粒的符号)得到了电子,反应的基本类型是:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰是治炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有 FeCO3、NiCO3等杂质)为原料生产金属锰的工艺流程如下图,请回答以下问题:
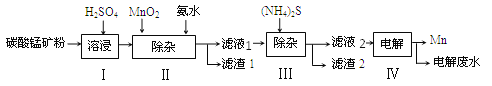
(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是_______,其中碳酸锰与硫酸反应的化学方程式为_________________。
(2)步骤Ⅱ中,先加入二氧化锰发生以下反应:MnO2+2FeSO4+2H2SO4=MnSO4+2H2O+x,x的化学式为______;已知滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,则步骤Ⅱ中加入氨水的主要目的是________。
(3)步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,则滤渣2中主要成分为______(填化学式)
(4)步骤Ⅳ中,电解后的废液中还含有Mn2+,常用石灰乳进行一级沉降得到沉淀Mn(OH)2和氨气,过滤后,再向滤液中加入Na2S进行二级沉降得到沉淀MnS。写出二级沉降过程中发生的化学反应方程式:___________________;沉降过程的产物中,______________________可循环利用于上述流程。
查看答案和解析>>
科目: 来源: 题型:
【题目】请运用所学化学知识填空:
(1)拉瓦锡通过实验测得,氧气约占空气体积的________;硫在氧气燃烧会伴随___________色火焰。
(2)从微观视角看,“春雨丽润泽桃花开,微风拂面清香来”说明_________; CH3COOH、HCl等物质的水溶液都能使石蕊溶液变为红色的原因是:它们的溶波中都含有_________(填微粒名称)。
(3)构成硫酸铁的阳离子符号为:_________;甲烷完全燃烧的化学方程式为:___________________。
(4)依据下图回答问题:
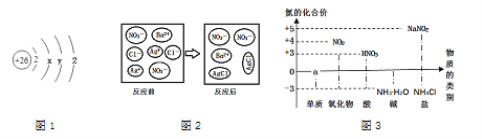
①图1中y的值为________
②另写1个与图2所示微观反应本质相同的化学方程式_____________·
③写出图3中a处的1种物质名称:_____________,其中位置放错的物质有:___________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各粒子的数目如下表所示.
粒子种类 |
|
|
|
|
|
反应前的数目 | 2n | 7n | 0 | x | |
反应后的数目 | 0 | n | 4n | 7n |
以下有关说法中,正确的是
A. 表中x=3n
B. 由![]() 构成的物质属于无机化合物
构成的物质属于无机化合物
C. 由![]() 构成的物质中,
构成的物质中,![]() 对应元素的含量约为72.7%
对应元素的含量约为72.7%
D. 由![]() 与
与![]() 构成的对应物质,在该反应中的质量比为16:9
构成的对应物质,在该反应中的质量比为16:9
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z3种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法中错误的是
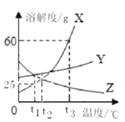
A. t2℃时,3种物质的溶解度的大小关系为Y>Z=X
B. X中含有少量Z,可以采用降温结晶的方法提纯X
C. 将溶质质量分数为25%的X溶液从t3℃降温到t1℃时,所得溶液中溶质的质量分数为20%
D. t3℃时,向盛有等质量X、Y、Z固体的3只烧杯中分别加水配成饱和溶液,所得溶液的质量大小为X>Y>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法中正确的是
A. 合金的硬度一般比组成它的纯金属更高,所以钢的硬度高于纯铁
B. 将一定量的锌粉投入足量稀酸中,充分反应后溶液质量会减小
C. 大力开采并出口金属矿物资源,可以有效促进我国经济迅速增长
D. 由“Na+KCl![]() K+NaCl”反应推知:钠的金属活动性比钾强
K+NaCl”反应推知:钠的金属活动性比钾强
查看答案和解析>>
科目: 来源: 题型:
【题目】(4分)我们学习化学的目的之一就是学会从化学的视角认识和分析生活生产中的一些问题。
(1)2013 年济南市整合趵突泉、大明湖、五龙潭、护城河等旅游资源,组建天下第一泉风景区,它集独特的自然山水景观和深厚的历史文化底蕴于一体,为 5A 级景区。

①对泉水的下列说法中明显错误的是 (填序号)
A.清澈的泉水是溶液 B.蒸馏是净化程度很高的净水方法
C.可用煮沸的方法降低泉水的硬度 D.过滤可以除去泉水中的可溶性杂质
②某化学小组的小泉同学取2滴非常清澈的趵突泉水滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是
。
③济南市区居民的大部分饮用水来自地表天然水,天然水转化成饮用水需经一系列净化,Cl2是一种廉价的自来水消毒剂,与水反应生成次氯酸(HClO)有较强的杀菌作用。氯气(Cl2)和次氯酸中氯元素的化合价分别是 。
(2)化学与食品安全、环境保护、人体健康等密切相关。下列说法错误的是 (填序号)
A.在食盐中添加适量碘酸钾,补充人体所需的碘元素
B.“低碳生活”倡导大量使用化石燃料,鼓励人们多开汽车出行
C.香烟的烟气中含有许多有毒物质,吸烟有害健康
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需配置一定浓度的硝酸钾溶液。
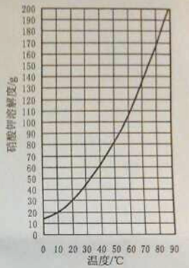
(1) 查阅硝酸钾溶解性。由右图可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数)。
(2)计算。配置40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL)。
(3)称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。
A、先移动游码到所需位置,再添加硝酸钾直到天平平衡
B、先添加所需的硝酸钾,再移动游码直到天平平衡
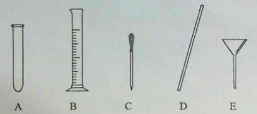
(4)量取。量取所需蒸馏水要用到的仪器是 (填字母)。
(5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。
(6)稀释。20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从下表中找出需要用到的数据: g/mL。
硝酸钾溶液的密度(单位1g/mL)
质量分数/% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com