
科目: 来源: 题型:
【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】![]() 白色沉淀A是什么?
白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量![]() 的固体混合物。
的固体混合物。
【理论推理】![]() 白色沉淀A是
白色沉淀A是![]() ,请写出生成该沉淀的化学方程式______。
,请写出生成该沉淀的化学方程式______。
![]() 滤液B中含有
滤液B中含有![]() 、NaOH、NaCl三种溶质。
、NaOH、NaCl三种溶质。
【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
I | 取少量滤液B于试管中,加入过量的 | ______ | 滤液B中含有 |
II | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | ______ | |
III | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入 ______ 溶液 | 产生白色沉淀 |
【拓展提升】
![]() 向步骤I中加入过量
向步骤I中加入过量![]() 溶液的目的是______。
溶液的目的是______。
![]() 小妮同学认为若将步骤I中的
小妮同学认为若将步骤I中的![]() 溶液换为
溶液换为![]() 溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______
溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______![]() 填“合理”或“不合理”
填“合理”或“不合理”![]() 。
。
![]() 小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的
小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的![]() 溶液,也能得出滤液B的溶质中含有
溶液,也能得出滤液B的溶质中含有![]() 和NaOH的结论,你是否同意他的观点并说明理由______。
和NaOH的结论,你是否同意他的观点并说明理由______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年4月16日,美国商务部宣布,禁止美国公司向中兴公司销售电子技术和通讯元件。其中一个聚焦点就是芯片技术,生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅,硅可由石英砂(主要成分是二氧化硅)制得,其生产流程如图所示:
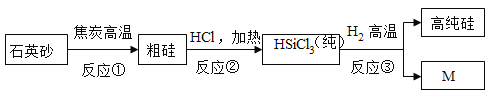
(1)上述三种半导体材料中属于金属材料的是_____,硅和锗的组成元素在周期表中的位置如图所示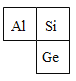 ,
,
则两种元素属于同一_____(填“周期”或“族”)
(2)硅原子结构示意图为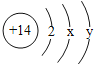 ,则x为_____,”14”表示_____。
,则x为_____,”14”表示_____。
(3)根据上述流程图推断,反应①中化合价发生变化的元素有_____;反应③中M的化学式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个图象分别对应四个变化过程,其中正确的是( )
A. 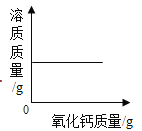 一定量的饱和石灰水中加入氧化钙
一定量的饱和石灰水中加入氧化钙
B. 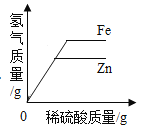 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C. 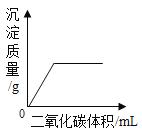 在一定量的CaCl2溶液中通入CO2气体
在一定量的CaCl2溶液中通入CO2气体
D. 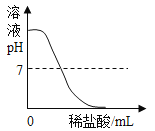 服用胃舒平[主要成分Al(OH)3]治疗胃酸过多,胃液pH的变化
服用胃舒平[主要成分Al(OH)3]治疗胃酸过多,胃液pH的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量盐酸和氯化铁溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
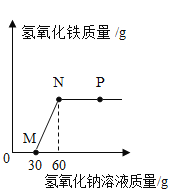
A. M点表示的溶液中只含有一种溶质
B. N点表示的溶液pH=7
C. P点和N点表示的溶液中,NaC1的质量分数相同
D. 从M点到N点溶液质量增加30g
查看答案和解析>>
科目: 来源: 题型:
【题目】是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
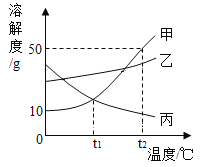
A. t1℃时,甲与丙两种物质的饱和溶液中溶质质量相同
B. 乙中混有少量甲时,应采用降温结晶的方法提纯乙
C. t2℃时,30g 甲能溶解于 50g 水中形成 80g 溶液
D. t2℃时,甲、乙、丙的饱和溶液降温到 t1℃时,其溶质质量分数大小为:乙>甲>丙
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的四个实验,得出的结论正确的是( )
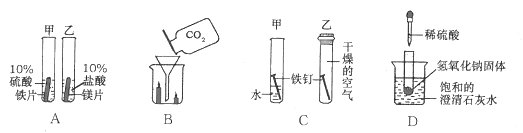
A. 乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁
B. 蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气
C. 甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈
D. 向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是

A. 图一中的转化1是酸雨形成的主要原因
B. 图二中可实现有机物与无机物的相互转化
C. 绿色植物通过光合作用,将太阳能转化成化学能
D. 碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定空气中氧气的含量,某课外活动小组设计并进行了如图所示的实验探究。下列有关说法不正确的是( )
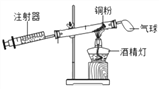
A. 该实验可用碳粉来代替铜粉进行测定
B. 该实验方法利用的是间接测量的方法
C. 造成该实验出现误差的原因可能是铜粉的量不足
D. 实验结束后,密闭装置内剩余气体的化学性质比较稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】侯德榜是我国著名的化学家。由他发明的侯氏制碱法制得的纯碱中含有少量氯化钠杂质。某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案
方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,发生如下反应Na2CO3+BaCl2=BaCO3↓+2NaCl
充分反应后,过滤、洗涤,干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品。(杂质可溶于水且不与氯化钡反应)
方案二:用如图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。称取纯碱固体2.0g,加入足量的稀硫酸,发生如下反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,完全反应,使气体放出,测得量筒中水的体积为330毫升,请你计算样品的纯度(本题中二氧化碳的密度取2.0g/L)
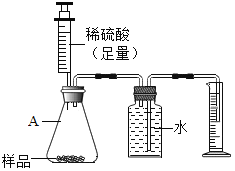
(1)请任意选择一种方案进行计算。________
(2)同学分析发现方案二所测的碳酸钠纯度偏低,造成此结果的原因可能是______(装置的气密性良好)
A A装置中残留反应产生的二氧化碳气体 B 部分CO2溶于水或与水反应
C 与量筒相连的导管中有水 D 量筒读数时,俯视读数。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(查阅资料)CO2在饱和碳酸氢钠溶液中几乎不溶解
(提出问题1)如何测量该部分变质样品中碳酸钠的质量分数?
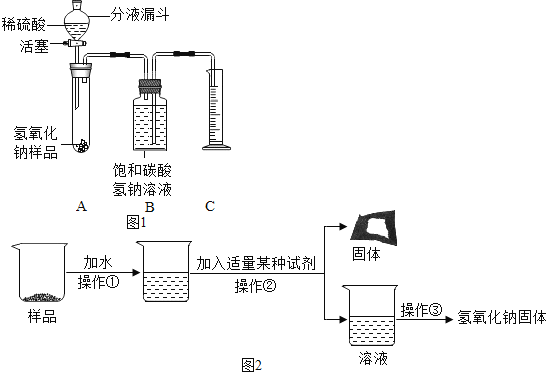
(实验探究1)小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是______;
(2)CO2残留在试管A中对实验结果是否有影响?说明理由______。
(提出问题2)怎样提纯该样品得到纯净的氢氧化钠固体?
(实验探究2)为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程
(3)最终所得氢氧化钠固体质量______变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
(实验反思)
(4)通过本题,你学会了定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有______(填数字序号);
①选择试剂种类②确定试剂用量③试剂产地④实验装置与步骤的设计⑤实验安全环保⑥测量中减少误差
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com