
科目: 来源: 题型:
【题目】2018年2月9日,歼﹣20开始列装空军作战部队。它是一款具备高隐身性、高态势感知、高机动性的隐形第五代战斗机。其隐身材料是目前最新的纳米高分子复合材料。芳纶是种可做此材料的新型高科技特种纤维,可由间苯二甲酰氯和间苯二胺缩聚而成。其中,间苯二胺的化学式是C6H8N2,试回答:

①间苯二胺属于_____(填写“无机物”有机物”之一)
②间苯二胺由_____种元素组成。
③间苯二胺分子中,H、N两种原子的个数之比为_____(最简整数比)。
④间苯二胺中,碳元素和氢元素的质量之比为_____(最简整数比)。
⑤间苯二胺中,所含元素质量分数最小的元素是_____(写元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上煅烧石灰石一段时间后,同学们取20g反应后的混合物,加入100g质量分数为15.6%的稀盐酸恰好完全反应,测得反应后的液体的质量为111.2g,得滤渣4.4g,则煅烧时分解的碳酸钙占原碳酸钙的质量分数为( )
A. 25%B. 50%C. 75%D. 20%
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲、乙、丙三种物质的溶解度曲线如图所示,但不知它们分别对应哪条曲线。根据以下信息
(1)甲和乙不可能配制成相同浓度的饱和溶液
(2)甲和丙中有一种物质,其接近饱和的溶液可通过升温达到饱和
(3)将t2℃三种物质的饱和溶液降温到t1℃,乙的溶质质量分数大于丙
下列说法正确的是( )
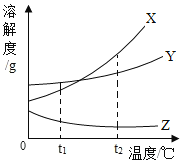
A. 曲线Y代表丙
B. t1℃时,三种物质的溶解度大小为:甲>乙>丙
C. t2℃时,分别将X、Y的饱和溶液降温至t1℃,X析出的晶体一定比Y多
D. t2℃时,等质量的甲、乙、丙饱和溶液中,甲的溶质质量分数最小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某反应的微观模拟示意图。下列从图中获得的有关信息中,不正确的是( )
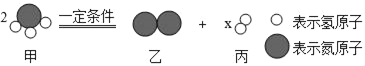
A. 图示中X的数值为3
B. 该化学反应类型属于分解反应
C. 该反应中分子和原子的种类都发生了改变
D. 该反应前后各元素的化合价都发生了变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某些粒子的结构示意图,下列说法错误的是( )
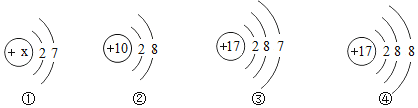
A. ①图表示原子,其中x的值9 B. 化学性质相似的原子是②④
C. 具有稳定结构的原子是② D. 属于同种元素的粒子是③④
查看答案和解析>>
科目: 来源: 题型:
【题目】正常情况下人的胃液PH为0.81.5 , 相应含HCl的溶质质量分数为0.2%0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显________性。
(2)若人的胃液总量为100mL,正常人胃液中HCl的质量范围为________g。
(3)医生给患者开的药品为胃舒平(有效成分是Al(OH)3),每片胃舒平含Al(OH)3的质量为0.39g 。请根据化学方程式计箅该患者至少服用多少片的胃舒平,胃液才能恢复正常_____?(请写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】今天上实验课时,张明同学发现,上个星期做实验用的NaOH溶液忘记了盖瓶塞。对于该溶液是否变质,同学们产生了兴趣,于是开始实验探究。
(猜想假设)
猜想(1):该溶液没有变质,为NaOH溶液。
猜想(2):该溶液全部变质,为Na2CO3溶液。
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液。
(查阅资料)Na2CO3溶液呈碱性,CaCl2溶液呈中性
(设计方案)请你完善下表几组同学探讨的设计方案
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
| 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是_______ |
第2组 |
| 若产生白色沉淀,反应方程式是:__________则猜想(1)不成立。 | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立。 |
第3组 | 第一步 第二步
| 若_____,则猜想(3)成立。 | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是_______ |
(探究实验)综合各小组的方案后,动手实验。
(结论与反思)NaOH溶液易与空气中CO2反应而变质,所以要_____保存。
查看答案和解析>>
科目: 来源: 题型:
【题目】课本第二单元课题3制取氧气,课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ①产生的气体是____ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的____和____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡 不同之处是________ | 红砖粉末的催化效果没有二氧化锰粉末好 |
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜为白色或灰白色粉末,吸水性很强,吸水后反应生成蓝色的五水合硫酸铜[Cu(H2O)4]SO4·H2O或CuSO4·5H2O],其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。硫酸铜常见的形态为蓝色晶体,即五水合硫酸铜,俗称胆矾或蓝矾,它并不稳定,在加热的条件下,逐渐失去结晶水而变成硫酸铜粉末,给硫酸铜粉末继续加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气。
硫酸铜有广泛的应用,如:工业上可用于电镀、定氨催化剂,无水硫酸铜用作脱水剂和气体干燥剂;农业上可与熟石灰混合制农药波尔多液,用于杀菌剂;医疗上可用于检测贫血及作催吐剂。
硫酸铜可以通过不同种方法制得,比如,下面的方法便可以制取硫酸铜。

硫酸铜属于重金属盐,有毒,对于人和动物都可因误食一定量而导致死亡,所以用量必须严格控制,若误食,应立即大量食用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。
(1)无水硫酸铜检验水存在的颜色变化是___。
(2)写出一种能制得硫酸铜的化学反应方程式___。
(3)在制备硫酸铜流程中,过滤后的溶液是___硫酸铜溶液(填“饱和”或“不饱和”)
(4)关于硫酸铜说法不正确的是___。
A 五水合硫酸铜的相对分子质量是250。 B 胆矾的化学性质不稳定。
C 无水硫酸铜可作气体干燥剂。 D 硫酸铜的水溶液也称作为波尔多液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com