
科目: 来源: 题型:
【题目】水是宝贵的自然资源,对于人类生活、工农业生产都具有重要的意义。
(1)水的净化
①自来水生产过程中,可用____方法除去水中不溶性杂质,用____去除水中色素和气味。
②可用____来检验地下水是硬水还是软水,生活中常用______的方法降低水的硬度。
(2)水是最常用的溶剂
实验室用蔗糖配制一定溶质质量分数的溶液时,可能涉及以下操作:
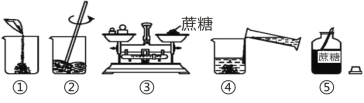
①上图操作中有错误的是________(填序号)。
②改正错误后,表示正确的操作顺序是_________。
A. ⑤②①③④ B. ⑤①②③④ C. ⑤③②④① D. ⑤③①④②
③用25g葡萄糖(C6H12O6)配制5%的葡萄糖溶液,配好后所得溶液中氢元素和氧元素的质量比为 ____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图装置,结合所学化学知识回答下列问题.
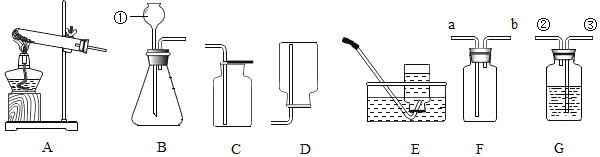
(1)请写标号仪器①的名称:______;
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为A装置存在的问题是______,可选用______(填C或D)装置收集氧气.若用E装置收集氧气,收集满氧气后,应先______,再熄灭酒精灯.该反应的化学方程式是______.
(3)实验室用石灰石和稀盐酸制取CO2气体,该反应的化学方程式是______验满的方法是______;此法制得的二氧化碳,常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的G装置来除去,则混合气体应从G装置的______端口(填“②”或“③”)通入,实验室用稀盐酸和石灰石制取CO2气体,而不用稀硫酸和石灰石,原因是______.
(4)将CO2通入紫色石蕊溶液中,溶液变成红色,加热后溶液又变成紫色,用化学方程式表示加热后又变成紫色的原因:______.
(5)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气大,易溶于水且水溶液显酸性.实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2.实验室制取SO2选择的发生装置是______(填字母),若选择F装置收集SO2,气体应该从______口(填“a”或“b”)进入,实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】(9分)同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究:

(1)探究成分
①小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是 。他取少量待测液于试管中,加入过量的稀HCl,看到 ,由此小张同学认为,溶液为Na2CO3溶液。
②小李同学对小张同学的结论提出疑问,拟进行了以下实验:取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,该反应方程式为 ,过滤,取滤液,(写出还需进行的操作及现象) 。通过实验,小李认为小张结论不正确。
③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中 的而变质。
(2)测定碳酸钠的浓度
取该试剂瓶中溶液50g倒入烧杯中,再向烧杯中逐滴滴加盐酸使其充分反应至无气泡产生(假设生成的二氧化碳全部逸出)。测得加入盐酸的质量与烧杯中的物质的质量关系如下表所示。
累计加入盐酸的质量/g | 0 | 25 | 37.5 | 50 |
烧杯中物质的总质量/g | 50 | 75 | 85.3[来] | 97.8 |
请你计算:
①这一测定过程中产生二氧化碳质量为 g。
②这一瓶试剂中碳酸钠的质量分数(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】把5.1g镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生0.5g H2,向反应后的溶液中加入一定量的NaOH溶液,恰好使上述溶液中的MgSO4 和Al2(SO4)3完全转化为沉淀,则同时生成的Na2SO4的质量为( )
A. 7.1gB. 28.4gC. 14.2gD. 35.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】用“![]() ”和“
”和“![]() ”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下发生化学反应生成新物质X,微观过程如图所示.下列说法正确的是( )
”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下发生化学反应生成新物质X,微观过程如图所示.下列说法正确的是( )
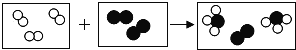
A. 反应前后分子种类不发生改变B. 该反应为置换反应
C. 参加反应的![]() 与
与![]() 分子数之比为 3:lD. 物质X含4种元素
分子数之比为 3:lD. 物质X含4种元素
查看答案和解析>>
科目: 来源: 题型:
【题目】味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
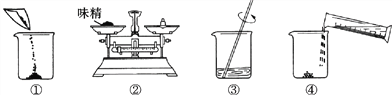
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(查阅资料)
(1) Na2SO3有较强还原性,在空气中易被氧气氧化:2 Na2SO3+O2==2Na2SO4;
(2) Na2SO3能与酸反应产生SO2气体;
(3)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
(作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3:_____________________。
(实验探究I)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | _____ | 已部分变质 |
(评价)有同学质疑甲组方案不合理,理由是___________。
(实验探究II)
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
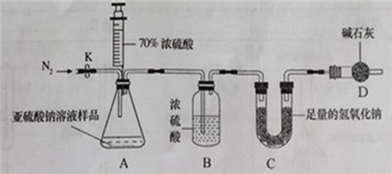
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g。
由此,计算出该溶液中Na2SO3的质量分数为_____________;
(解释)若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的____(填”偏小”或”偏大”)。
乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。
第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数=(1-142b/233a)×100%。
试完成下列问题:
(1)加入氯化钡溶液过量的目的是________________;
(2)第三步操作要洗涤沉淀的原因是______________________;
(反思)由此可得出,保存亚硫酸钠时应___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应在防治环境污染中扮演了重要角色。某工厂废气中的SO2,可用以下方式处理。
方式一:2SO2+O2+2CaO═2CaSO4 方式二:2SO2+O2+4NaOH═2Na2SO4+2H2O
试计算:(已知:CaSO4的价格为700元/吨,相对分子质量为CaSO4 136 Na2SO4 142)。
(1)CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和_____。
(2)若用方式一处理9.6tSO2,所得产品价值多少元?_____
(3)若用方式二处理9.6tSO2,刚好用去50t一定浓度的NaOH溶液,求所得溶液的溶质质量分数_____(最终结果精确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com