
科目: 来源: 题型:
【题目】氧元素由化合态转化为游离态的变化是( )
A. 2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
B. H2CO3![]() H2O+CO2↑
H2O+CO2↑
C. 4P+5O2![]() 2P2O5
2P2O5
D. 2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是甲、乙实验小组完成的相关实验。
甲小组:利用下图装置研究燃烧条件(已知白磷的着火点为40℃)。
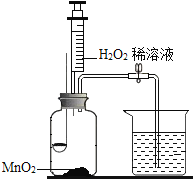
步骤Ⅰ:烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。
步骤Ⅱ:用注射器向瓶内推入适量H2O2 溶液
(1)H2O2稀溶液与MnO2接触时发生反应的文字表达式为_____;
(2)实验中,推入H2O2溶液前,燃烧匙中的白磷不燃烧,原因是_____;推入H2O2溶液后,观察到烧杯中的现象是_____。
乙小组:哪些因素影响过氧化氢分解的速率?
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验对比可知,化学反应速率与浓度和温度有关系。
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子相互接触、碰撞的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:_____;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量_____(填“减小”或“不变”或“增大”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F均为初中化学中常见的物质,且除E外它们组成中都含有地壳中含量最多的元素,其中A、C均为无色液体且组成元素相同,B为黑色固体,它们的转化关系如图所示(部分反应的条件省略)“→”代表转化。
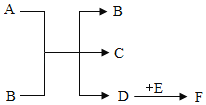
(1)写出下列物质的化学式:C_____D_____
(2)若F也为黑色固体,则D与E反应的文字表达式为_____;基本反应类型是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取气体的一些装置,据图回答有关问题。
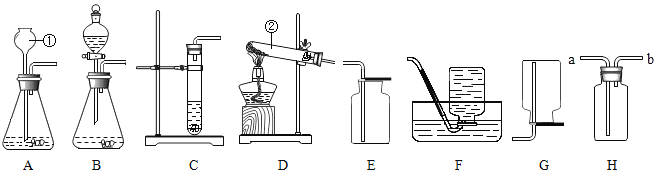
(1)写出指定仪器的名称:②_____;
(2)写出用装置D制取氧气的文字表达式_____,实验室常用来收集氧气的装置是_____;
(3)实验室常用锌粒和稀硫酸溶液反应生成硫酸锌和氢气来制取氢气,已知氢气难溶于水,密度小于空气密度。其中装置A、B、C都可以用来实验室制取氢气,比较这三个装置的不同,指出B装置的一个突出优点_____,如果用H图所示装置收集氢气,气体应从_____(填“a”或“b”)端管口通入。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富.下面是元素周期表部分内容,请回答下列问题

(1)表中不同种元素最本质的区别是原子中_____不同;
(2)从表中可查出硅元素的相对原子质量为_____;
(3)第11号元素与第17号元素组成的化合物是_____,构成该物质的微粒是_____(选填“分子”、“原子”或“离子’’)
(4)碘元素能预防甲状腺疾病,请根据如图推断碘元素在周期表中位于第_____周期;
(5)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的文字表达式为:_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】水是宝贵的自然资源,是人类生命之源.
(1)为了净化河水,可以向其中添加明矾,明矾的作用是_____;
(2)生活中既可以软化硬水,又可以消毒杀菌的方法是_____;
(3)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒.制取ClO2的反应过程示意图如下,请回答:

C物质中氯元素的化合价是_____.
(4)水与人类生活息息相关,下列关于水的说法,错误的是_____.(填字母)
A 自然界中的水都是混合物
B 使用无磷洗涤剂有利于防止水体富营养化
C 水电解产生氢气和氧气,说明水分子中含氢分子和氧分子
D 用活性炭除去水中的色素和异味
E 我们把含有较多可溶性钙、镁化合物的水称为硬水
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图所示试剂瓶中分别盛有四种常见的化学药品。
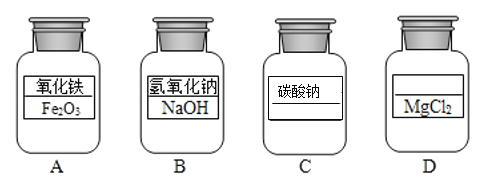
①C 瓶中药品的化学式为_____;
②D瓶中药品的名称是_____。
(2)用适当的数字和化学用语填空:
①2个氮分子_____;
②3个镁离子_____;
③能保持氢气化学性质的粒子_____;
④氯酸钾中氯元素显+5价_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A.![]() 表示钠原子失去1个电子后形成的离子
表示钠原子失去1个电子后形成的离子
B.![]() 表示带2个单位负电荷的碳酸根离子
表示带2个单位负电荷的碳酸根离子
C.![]() 表示氧原子得到1个电子后形成的离子
表示氧原子得到1个电子后形成的离子
D.![]() 表示由2个氢原子和2个氧原子构成的过氧化氢分子
表示由2个氢原子和2个氧原子构成的过氧化氢分子
查看答案和解析>>
科目: 来源: 题型:
【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验 编号 | 硫酸的质量 分数(均取 20 mL) | 锌的形状 (均取1 g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式:________________________。
(2)小兵用如图所示装置收集并测量氢气的体积,其中量筒的作用是________________________________________,氢气应从________(填“e”“f”或“g”)管通入。
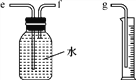
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是________________________________________________________________。
(5)下表是小兵第①组实验的详细数据。
时段(均 为1分钟) | 第1 分钟 | 第2 分钟 | 第3 分钟 | 第4 分钟 | 第5 分钟 | 第6 分钟 |
H2的体积 | 3.1 mL | 16.7 mL | 11.9 mL | 9.6 mL | 7.6 mL | 6.0 mL |
请描述锌与硫酸反应的快慢的变化并解释原因:______________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业烟气通常含二氧化硫,在排放前需经脱硫处理![]() 如图是两种常用脱硫工艺中含硫物质的转化路径
如图是两种常用脱硫工艺中含硫物质的转化路径![]() 部分产物已略
部分产物已略![]() .
.
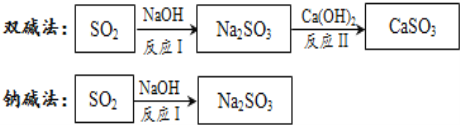
(1)下列环境问题与![]() 有关的是 ______
有关的是 ______ ![]() 填字母序号
填字母序号![]() .
.
A酸雨 B温室效应 C臭氧空洞
(2)双碱法中的“双碱”指的是 ______![]() 填化学式
填化学式![]() .
.
(3)写出反应Ⅰ的化学方程式: ______ .
(4)反应Ⅱ所属的基本反应类型是 ______ .
(5)已知部分原料的价格如下表所示.
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
两种工艺中,处理相同量的SO2,双碱法所需的原料成本更低,原因是______![]() 物质组成和变化分析
物质组成和变化分析![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com