
科目: 来源: 题型:
【题目】如下图所示,在白色点滴板 1~6 的孔穴中,分别滴加 2 滴紫色石蕊溶液。
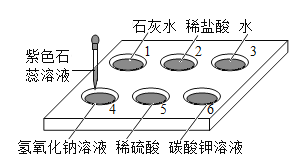
(1)PH<7 的孔穴有_____(填孔穴序号,下同)。
(2)孔穴 6 中溶液变为蓝色,说明碳酸钾溶液显 _____(填“酸性”或“碱性”)。
(3)溶液变为红色的孔穴有_____。
(4)作为空白对照实验的孔穴是_____。
(5)再向孔穴 4 中滴加稀硫酸,溶液变为紫色,用化学方程式解释其原因:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用手机传感器可以验证氢氧化钙溶解性随温度升高而减弱(溶解度曲线如下图所示)。操作步骤为:
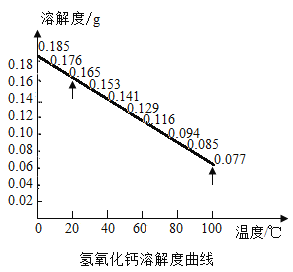
(1)配制氢氧化钙溶液:20℃时,用托盘天平称取10g氢氧化钙固体,放入盛有300g蒸馏水的烧杯中,此时配制的氢氧化钙溶液为_______溶液(填“饱和”或“不饱和”)。
(2)用50mL小烧杯取30mL步骤(1)所得上层清液,滴入无色透明的油,使其在液面上形成一层油膜。将小烧杯置于手机光照传感器上,分别测出加热前后光照度数值,对比可以发现温度对氢氧化钙溶解度的影响。用化学方程式解释滴油的原因_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】味精为白色柱状晶体,其主要成分为谷氨酸钠(C5H8NO4Na)和食盐,可用于食品增鲜。经实验测定发现,当加热至100℃以上时,会引起部分失水,生成焦谷氨酸钠,失去鲜味,且有轻微毒性。如图是焦谷氨酸钠含量与加热温度、加热时间的关系。

(1)味精的物理性质是________。
(2)分析右图得到的结论是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度不变,对100 mL氯化钠饱和溶液进行如图所示实验。下列结论不正确的是
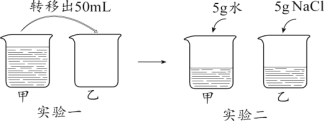
A. 实验一后,甲和乙中溶质质量分数相等B. 实验二后,乙溶液溶质质量分数增大
C. 实验二后,甲溶液变为不饱和溶液D. 实验二后,甲和乙溶液中溶质质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应前后分子种类变化的微观示意图如下。下列说法正确的是
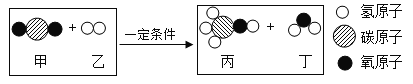
A.丙中碳氢元素的质量比为 4:1B.反应前后分子总数不变
C.参加反应的甲、乙的质量比为 22:3D.该反应属于置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文
碳元素是最早被人类认识和利用的元素。碳元素在地球上虽然广泛分布,但其含量不足 0.03%。
碳元素是一切有机体骨架的组成元素,在人体中的含量约占 18%。主要以有机含碳化合物形式存在,如糖类、蛋白质等。人体中的无机含碳化合物种类较少,在血浆中主要以碳酸氢盐缓冲系统(H2CO3/HCO3-)的形式存在,人体细胞通过有氧氧化和无氧酵解产生的二氧化碳,是碳元素在人体内的另一种无机形式。
迄今为止,发现了 15 种碳原子,它们在元素周期表中占据如图 1 所示的同一个“格”,其中 C-12 和 C-13 属于稳定型,考古研究中,通过测定 C-14 含量估算古物的年代。

20世纪起,人类对碳元素的认识突飞猛进。下表列出了与之相关的主要事件。碳的这些新型结构的发现和性能研究的发展,使其广泛应用于工业、材料、生物医学等领域。依据文章内容回答下列问题:
时间 | 40 年代 | 1967 年 | 1969 年 | 1985 年 | 1991 年 | 21 世纪 |
事件 | 发现C-14 | 发现六角金刚石和单斜超硬碳 | 发现银白色的白炭 | 发现富勒烯的第一个成员C60(图 2) | 发现碳纳米管(图 3) | 从石墨中剥离出仅由一层碳原子构成的薄片-石墨烯(图 4) |
(1)碳在人体中的存在形式有______________________种。
(2)结合你所学的知识,你认为 C-12 和 C-13 的不同点是______________________。
A 质子数不同 B 电子数不同 C 中子数不同
(3)C60 的含义是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了突出贡献在实际生产的产品碳酸钠中会混有少量的氯化钠,现有该样品混合物20.4g,将其放入洁净的烧杯中,向其中逐滴滴入7.3%的稀盐酸,放出气体质量与滴加稀盐酸质量的关系如图所示。请回答下列问题:
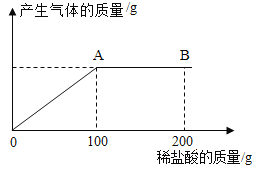
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH_____7(填“<”“>”或“=”)
(2)该样品混合物中碳酸钠的质量_____g;
(3)当滴加稀盐酸至图中A点时,烧杯中所得溶液为不饱和溶液,请计算此时溶液中的溶质质量分数。(写出计算过程,计算结果保留至0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】小苏打和食盐是厨房中常见物质。现有一包白色固体,可能由碳酸氢钠、氯化钠中的一种或两种物质组成。某科学小组同学展开了系列研究。
(一)定性分析
(实验目的)确定白色固体的组成
(实验方案):如图1所示
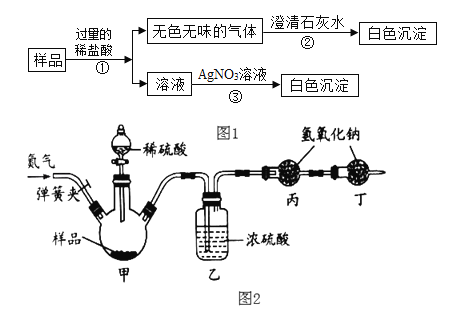
(实验结论)小明同学经过上述实验得出结论:该白色固体由碳酸氢钠、氯化钠两种物质组成。
(1)步骤①发生反应的化学方程式是_____;
(2)步骤②中的澄清石灰水也可以用其它碱溶液代替,如_____;
(3)科学小组认真研究讨论后认为,此方案不能得出小明同学的结论。一致认为将上述方案中使用的一种试剂进行调换,如仍出现上述现象,则小明同学的结论正确。调换措施是_____。
(二)定量分析
(实验目的)测定该白色固体中碳酸氢钠的质量分数
(实验方案)该小组利用图2所示的实验装置(固定装置已略去,装置气密性良好)进行实验,每一步反应均完全进行。
(1)首先称取a克该样品放入装置甲中,然后进行有关实验操作,正确的顺序是_____(填序号,可重复选择)
a.称量装置丙的质量
b.打开弹簧夹,通入足量的氮气,关闭弹簧夹
c.打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞
(2)如果没有装置乙,会造成测定结果_____(填“偏大”“偏小”或“不变”);
(3)装置丁的作用是_____。
(三)拓展交流
经査阅材料:将二氧化碳气体持续通入一定量的氢氧化钠溶液中会先后发生以下两个化学反应:
①2NaOH+CO2=Na2CO3+H2O ②Na2CO3+CO2+H2O=2NaHCO3
小明同学将5g二氧化碳气体通入100g 5%的氢氧化钠溶液中,充分反应后,所得溶液的溶质是_____(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
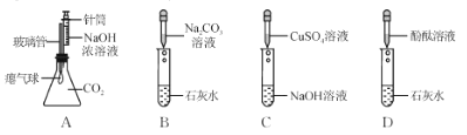
(1)实验 A 中,推入 NaOH溶液后,可观察到的现象是____。
(2)实验B 中发生反应的化学方程式为______。
实验结束后,小组同学对B 试管中上层清液的溶质成分产生疑问,作出猜想:
猜想一:只含有 NaOH;猜想二:含有 NaOH、Na2CO3;猜想三:含有 NaOH、Ca(OH)2。同学们取少量B 试管中的清液分别置于甲、乙两支试管中,进行探究:
实验操作 | 实验现象 | 结论 |
在试管甲中滴加碳酸钠溶液 | 不产生白色沉淀 | 猜想三错误 |
在试管乙中滴加足量稀盐酸 | ______ | 猜想二正确 |
(3)A、B、C、D 四个实验中能体现碱化学通性的是 ____(填字母)。小组同学经过 讨论认为 A、B、C、D 四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其它化学通性。实验的方案是___________(写出操作和现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛广泛用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如图1所示,请回答下列问题。
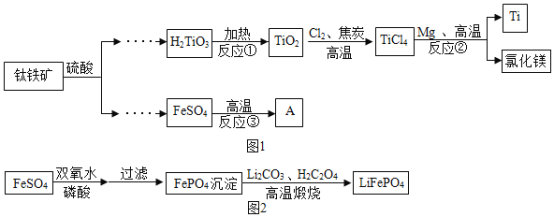
(1)构成金属钛的微粒是_____(填“分子”“原子”或“离子”),标出H2TiO3中钛元素的化合价_____。
(2)反应②需持续通入氬气,氩气的作用是_____。
(3)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为_____;
(4)对反应③进行改进,可直接生产锂离子电池的电极材料LiFePO4,工艺流程如图2所示:写出“高温煅烧”由FePO4制备LiFePO4的化学方程式_____(其中一种产物能造成温室效应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com