
科目: 来源: 题型:
【题目】实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验。请根据实验回答:
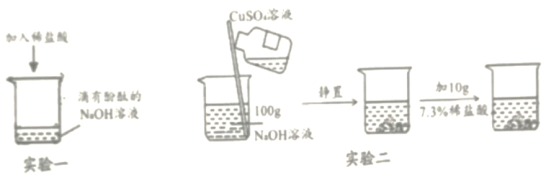
(1)甲同学进行了实验一,能观察到的明显现象是__________,同时测定反应后溶液的pH=2,说明酸能与碱发生化学反应。
(2)乙同学进行了实验二,当倒入CuSO4溶液观察到现象是_________,再加入稀盐酸,发现无明显变化,于是得出“酸不一定能与碱反应”的结论。丙同学对此产生质疑,用pH试纸测定实验二反应后混合物中上层清液pH=12,说明上层清液溶质中含有__________。你认为丙同学质疑乙同学结论的原因是________。
(3)丁同学利用上述实验后的废液继续实验。将实验二反应后的混合物过滤,得滤渣和滤液。将滤渣分为两等份,向一份滤渣中逐滴加入实验一所得溶液,能说明酸与碱发生化学反应的现象是________,反应的化学方程式是________,将另一份滤渣洗涤、晾干、称量,质量为0.98g.
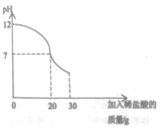
(4)戊同学向丁同学的滤液中继续逐滴滴加质量分数为7.3%的稀盐酸30g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。乙同学所用NaOH溶液溶质的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年5月11日,滨海港高铁站通车,滨海人实现了高铁出行。

(1)高铁建设施工过程中产生的废水、废浆以及机械漏油等,会对水体产生污染, 使用活性炭可对污水进行处理,这是利用了活性炭的________性。列车车体使用的镁铝合金属于________(选填 “金属材料”或“合成材料”),镁铝合金的优点是________。
(2)高铁建设中使用了大量的钢铁。工业上用赤铁矿(主要成分氧化铁)冶炼铁的化学方程式为_________。钢轨上喷防锈涂料,可防止生锈,该防锈方法的原理是________。金属矿物储量有限,保护金属资源,除防止金属锈蚀外,还可以________。(写出一条即可)。
(3)在高铁站建设中,安装了自动喷淋系统,喷出的水能灭火的原因是________。
(4)高铁信息传输系统中使用的电子芯片的关键材料是晶体硅(Si),工业上生成硅的反应是: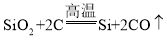 ,该反应的基本类型是_______反应。利用该反应生产含硅质量分数为98%的粗硅8吨,至少需要________吨含80%SiO2的石英砂。
,该反应的基本类型是_______反应。利用该反应生产含硅质量分数为98%的粗硅8吨,至少需要________吨含80%SiO2的石英砂。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学就在我们身边。
(1)现有: a稀有气体;b氯化钠;c小苏打;d碳酸钙;e熟石灰;f二氧化碳。请选择适当物质的序号填空。
①可作气体肥料的是____________。
②可用于培制糕点的是___________。
③可作补钙剂的是___________。
④可用于配制生理盐水的是__________。
⑤可用于制作霓虹灯的是__________。
⑥可用于改良酸性土壤的是__________。
(2)84消毒液对新型冠状病毒有一定的杀灭作用, 它的主要成分次氯酸钠(NaC1O).
①NaClO中氯元素的化合价为__________。
②工业上可用氢氧化钠溶液与氯气反应来制取次氯酸钠,其反应原理为![]() ,则X的化学式为________。
,则X的化学式为________。
③学校新购进一批次氯酸钠质量分数为8%的84消毒液,需将其稀释为0.4%后再使用,稀释时取原液与水的质量比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铵(NH4NO3)受热可分解为N2、H2O和某种氮的氧化物X.取一定质量的NH4NO3固体充分加热,测得反应后生成N2、H2O、X的质量分别为mg、14.4g、9.2g.下列说法正确的是
A.NH4NO3属于复合肥
B.该反应方程式中N2与H2O的化学计量数之比为1:4
C.X的化学式为NO
D.m=8.4
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
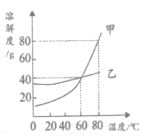
A.80℃时,甲物质的饱和溶液中溶质与溶剂的质量比为4∶5
B.用蒸发结晶的方法可从乙物质的饱和溶液中获得乙固体
C.分别将60℃的甲、乙物质的饱和溶液升温至80℃,此时甲物质溶液的溶质质量分数大于乙
D.60℃时,向140g甲物质的饱和溶液中,先加50g水,再加20g甲物质,充分溶解后溶液仍饱和
查看答案和解析>>
科目: 来源: 题型:
【题目】点燃条件下,甲与一定量的乙反应生成丙和丁的微观示意图如图。下列说法正确的是

A.该反应前后,原子的个数发生改变
B.该反应的化学方程式为: 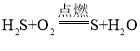
C.若在该反应中继续通入足量的乙,则乙与丙可进步反应
D.上述图示反应中涉及到两种氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图判断以下说法中正确的是
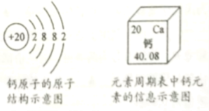
A.钙元素为非金属元素
B.钙的相对原子质量是40.08g
C.钙离子的核外电子数为20
D.“Ca”既可表示单质钙,又可表示钙元素
查看答案和解析>>
科目: 来源: 题型:
【题目】某氢氧化钠样品中可能混有Na2SO4和Na2CO3杂质,化学实验小组的同学们为了探究该氢氧化钠样品中杂质的成分,并提纯样品,做了如下探究实验:取少 量氢氧化钠样品,加足量水溶解,待用。
(实验探究1)甲同学:如图所示,取一定量氢氧化钠样品溶液于试管中,向其中加入稀硫酸,观察到溶液中有气泡冒出,再向其中滴加硝酸钡溶液,观察到溶液中有白色沉淀产生
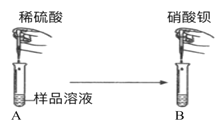
(1)请你写出该过程中,最先发生的化学反应的方程式:___________;
(2)根据实验现象,甲同学得出结论:样品中含有的杂质为碳酸钠和硫酸钠。 请你评价甲同学的实验结论:________。
(提出问题)将B试管中混合物过滤,测得滤液pH>7,则所得滤液中含有哪些离子?
猜想一:Na+、NO3-、OH-、Ba2+
猜想二:Na+、NO3-、OH-、SO42-
猜想三:Na+、NO3-、CO32-
(3)你的猜想是:________ (填离子符号)
(4)上述猜想中一定错误的是________。
(实验探究2)乙同学:另取少量氢氧化钠样品溶液于试管中,向其中先加入________,再加入硝酸钡溶液,观察到_________,则证明样品中含有两种杂质。
(表达与交流)同学们经过讨论后认为,要除去氢氧化钠样品中的杂质,只需要向样品的溶液中加入一种试剂,即_________溶液,充分搅拌后过滤,蒸发结晶即可得到纯净的氢氧化钠固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E分别表示初中化学常见的物质或溶液,属于不同类别,它们的部分反应关系和转化关系如图所示(图中用“一”表示两种物质能发生化学反应,“→”表示一种物质能转化成另一种物质,且省略部分反应物或生成物及条件),其中C是石灰石的主要成分。
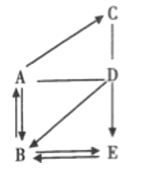
(1)请写出下列物质(溶液的溶质)的化学式:A______E______;
(2)写出B生成E的化学反应方程式__;
(3)写出C与足量D溶液反应的实验现象__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
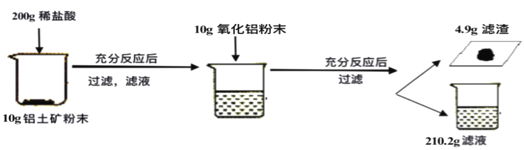
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 ___________;
(2)铝土矿中Al2O3的质量分数为_______;
(3)列出求解与铝土矿反应消耗的稀盐酸中溶质质量(X)的比例式__________;
(4)若要使最终所得滤液溶质质量分数变为10%,接下来的操作__________;
(5)该炼铝厂每天用上述铝土矿50t来生产铝合金,则理论上日产含镁40%的铝镁合金的质量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com