
科目: 来源: 题型:
【题目】氧化亚铜与稀硫酸反应的化学方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O。
(1)氧化亚铜中铜、氧元素质量比为___________ 。
(2)实验室用98%的浓硫酸配制1000g、9.8%的稀硫酸,需要水的质量为_____________。
(3)取一定量的氧化亚铜,加入9.8%的稀硫酸恰好完全反应,过滤、洗涤、干燥得红色固体3.2g。计算:参加反应的稀硫酸的质量__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾晶体。某课外活动小组的同学按如下流程进行实验。(反应中部分生成物已略去)
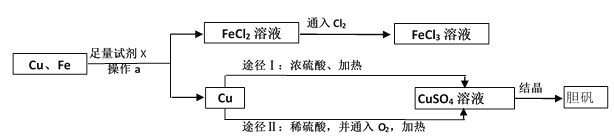
已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;2Cu+2H2SO4(稀)+ O2
CuSO4+SO2↑+2H2O;2Cu+2H2SO4(稀)+ O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
回答下列有关问题:
(1)操作a的名称是___________,若要得到纯净、干燥铜粉,还需进行的操作是___________、烘干。
(2)除去铜粉中的铁粉,可选用的物理方法是___________,本题利用试剂X除去铜粉中的铁粉,可观察到“有气泡放出”,反应的化学方程式为____________,该反应的基本反应类型是__________。
(3)FeCl2溶液中通入Cl2发生化合反应,写出该反应的化学方程式______________。
(4)由Cu制CuSO4溶液,途径Ⅱ中,若不通入O2,反应不会发生,原因是__________,途径Ⅱ与途径Ⅰ相比较,其显著的优点是__________(回答一点即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.生活中,常会接触到下列物质:A铜丝 B氢气 C氧化铝 D铁锈。其中属于混合物的是_________(填序号,下同),属于金属单质的是________,属于氧化物的是__________.
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水)
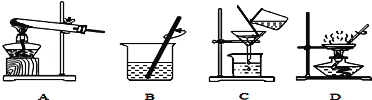
①图A中试管口略向下倾斜的原因是__________,图B操作中玻璃棒的作用是________。
②图C操作中的一处明显错误是__________,图D操作中,当看到__________,停止加热。
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.下列表述正确的是________。
A蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B40g S和32g O2完全反应后,生成的SO2为64g
C在化学反应aA+bB=cC+dD中一定有:a+b=c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是目前使用最广泛的金属,请回答:
(1)铁可以用来制作炊具,受热后炊具温度能较快升高,这是利用了铁的_____性;油罐车的尾部经常有一条铁链拖到地上,用来防止静电引起火灾,这是利用了铁的_________性。
(2)金属腐蚀造成的损失巨大,钢铁防腐尤为重要。下列钢铁制品的防护措施不合理的是________。
A在车船的表面喷涂油漆 B将使用后的菜刀用布擦干
C在铁制品表面镀上一层锌 D用洗涤剂把铁制品表面的油膜洗净
(3)实验室模拟炼铁的实验装置如图所示。试回答下列问题:
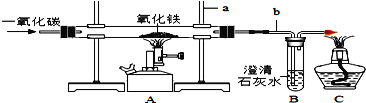
①写出有标号仪器的名称:a._______,b.__________。
②实验中看到A装置中的实验现象为:玻璃管中的粉末___________。
③A装置玻璃管中反应的化学方程式为______________。
④C装置的作用是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从微观的角度了解物质极其变化,有助于更好的认识物质组成和变化的本质。
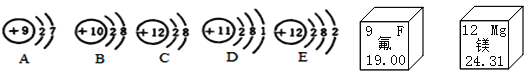
(1)已知A的相对原子质量为19,粒子A核内中子数为___________,A与E形成化合物的化学式为_____________。
(2)粒子A、B、C、D、E中,属于同一种元素的是___________(填序号),属于第二周期的元素共___种。
(3)D、E化学性质不同的原因是_____________。
(4)如图为两种化合物在一定条件下发生反应的微观示意图:
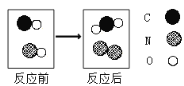
①该反应的化学方程式为__________________。
②上述反应中,作为还原剂的物质是________________(填物质化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图.下列说法中不正确的是

A..该反应为分解反应
B..丙可能为该反应的催化剂
C.参加反应的乙、丁质量比为3:2
D.丁相对分子质量是甲的2倍
查看答案和解析>>
科目: 来源: 题型:
【题目】推理是一种重要的思维方法,以下推理合理的是( )
A.置换反应有单质生成,所以有单质生成的反应一定是置换反应
B.镁、铁等金属单质能与稀盐酸反应,银也能与稀盐酸反应
C.溶液具有均一性、稳定性,则均一、稳定的液体均为溶液
D.点燃氢气前需要检验纯度,所以点燃一氧化碳等可燃性气体前也需要检验纯度
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙两种固体的溶解度曲线,下列说法中正确的是( )
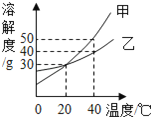
A. 40℃时,100 g甲的饱和溶液中含有50 g甲
B. 20℃时,甲、乙溶液中溶质质量分数相等
C. 升高温度可将乙的饱和溶液转化为不饱和溶液
D. 将40℃时甲的饱和溶液降温至20℃,析出晶体质量为20 g
查看答案和解析>>
科目: 来源: 题型:
【题目】人类文明的发展和社会的进步同金属材料关系十分密切。
(一)铁的应用及防护
(1)生活中常用铁锅烹饪,主要利用铁的_____(填字母)。
a 导电性 b 导热性 c 耐腐蚀
(2)“发蓝“处理是在铁表面形成致密氧化膜,以防止其腐蚀。“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为_____
(3)患贫血症的人体内需要补铁 ____(填字母)。
a 分子 b 原子 c 元素
(4)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是____(选填序号)。

(5)铁生锈的主要过程为:
![]()
写出Fe(OH)2→Fe(OH)3反应的化学方程式______。
(二)铁的冶炼和探究
取20.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
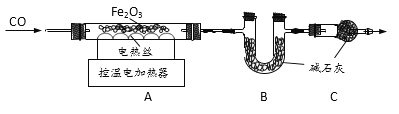
资料:碱石灰可吸收H2O和CO2。
(1)连接装置,先____,再装入药品。
(2)实验时先通入CO,目的是___。
(3)该实验装置有一个明显缺陷,你认为是___。
(4)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____。
②现直接测得装置A中剩余固体质量为17.2g。则装置B中固体应增重___g。
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①固体中Fe质量为______g。 ②FexOy的化学式为____。
(三)成分探究
(查阅资料)用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO ![]() Fe+CO2
Fe+CO2
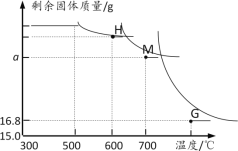
另取一定量Fe2O3进行上述实验,加热时固体质量随温度变化的曲线如图所示.回答下列问题:
(1)温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是____。
(2)图中H点对应的固体成分的化学式是____
(3)图中M点对应a的数值=___
查看答案和解析>>
科目: 来源: 题型:
【题目】将光亮镁条放入一定量的稀HCl中,产生大量气泡后出现灰白色固体。某同学对该现象作如下探究。(已知:MgCl2晶体能溶于水)
(一)产生气泡反应的化学方程式____。
(二)过滤、洗涤、室温晾干得灰白色固体。对灰白色固体作如下猜测并进行实验:
(猜测)灰白色固体可能是:①剩余的Mg; ②____; ③Mg和MgCl2晶体。
(实验1)(1)取灰白色固体样品,加入稀HCl,无气泡产生,则猜测 __(选填序号)不成立。(2)称取等质量的灰白色固体和MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解,而MgCl2晶体全部____,则猜测②不成立。
(查阅资料):灰白色固体的成分为碱式氯化镁,化学式可表示为Mgx(OH)yClznH2O[即每个Mgx(OH)yClz结合了n个H2O],它受热分解可产生氧化镁、氯化氢和水。
(实验2)另取该灰白色固体47.5g,按照正确的操作步骤进行受热分解实验,待反应停止后,测得氧化镁固体质量为24.0g,水的质量16.2g。
(问题讨论)
(1)X:Z=____。
(2)Mgx(OH)yCl的化学式可能是 ______。
(3)若沉淀Mgx(OH)yClznH2O中,n=5,则Y的数值为____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com