
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
科目:高中地理 来源: 题型:
【题目】根据下图回答下列问题。
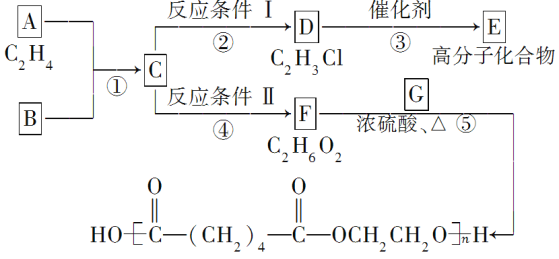
(1)写出A、E、G的结构简式:A___________,E____________,G_____________。
(2)反应②的化学方程式(注明反应条件)是___________________________;
反应④的化学方程式(注明反应条件)是________________________。
(3)写出反应①⑤的反应类型:①____________、⑤____________。
(4)写出反应⑤的化学方程式:______________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。
其流程如下图,已知沉淀2为蓝色。
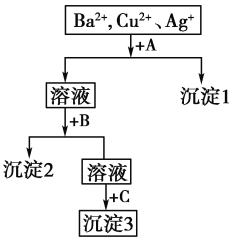
(1)写出沉淀的化学式:沉淀1______;沉淀3________。
(2)写出混合液+A的离子方程式_________________,溶液+B的离子方程式________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”填空:
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果________________;
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果________________;
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果________________;
(4)滴定前平视,滴定终了俯视,使滴定结果______________;
(5)滴定前仰视,滴定终了平视,使滴定结果______________;
(6)过早估计终点,使滴定结果__________________________;
(7)过晚估计终点,使滴定结果__________________________;
(8)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________________;
(9)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________________;
(10)洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】常温下,有两种溶液:①0.1 mol·L1 CH3COOH溶液 ②0. 1 mol·L1 CH3COONa溶液。
(1)溶液①的pH______7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是__________________________________________________。
(2)溶液②呈______性(填“酸”“碱”或“中”)。其原因是__________________________________
(用离子方程式和适当的叙述说明)。
(3)下列说法正确的是________(填序号)。
a.两种溶液中c(CH3COO)都等于0.1 mol·L1
b.两种溶液中c(CH3COO)都小于0.1 mol·L1
c.CH3COOH溶液中c(CH3COO)小于CH3COONa溶液中c(CH3COO)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与加入的NaOH的物质的量之间的关系曲线。
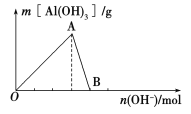
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com