
【题目】下图是元素周期表的简略框架图。
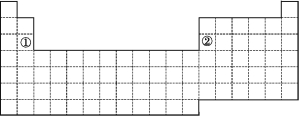
(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线。按电子排布,可把元素划分成5个区,不全是金属元素的区为 。
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的第 族;有人建议将氢元素排在元素周期表的第ⅦA族,请你写出支持这一观点的一个化学事实: 。
(3)上图中元素①②原子的价电子排布式分别为 、 。
比较元素①与元素②的下列性质(填“>”或“<”)。
原子半径:① ②;电负性:① ②;
金属性:① ②;第一电离能:① ②。
(4)某短周期元素最高正化合价为+7,其原子结构示意图为 。
【答案】(1)
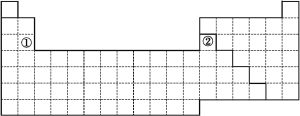
s区和p区
(2)ⅣA 氢原子得到一个电子达到最外层2电子的稳定结构(其他合理答案如与碱金属元素一样可形成离子化合物M+[∶H]-或NaH的存在等均可)(3)3s2 3s23p1 > < > > (4) +17
【解析】(1)金属元素与非金属元素的分界线是非金属元素的硼、硅、砷、碲、砹与金属元素铝、锗、锑、钋之间的分界线,按电子填充顺序把元素周期表划分为5个区,即s区、p区、d区、ds区和f区,其中s区中的氢以及p区的大部分元素不是金属元素。
(2)最高正化合价与最低负化合价绝对值相等的族为第ⅣA族;氢原子得到1个电子达到稳定结构,这一特点同第ⅦA族元素相同。
(3)由①和②在元素周期表中的位置可以确定①和②分别为Mg和Al,价电子排布式分别为3s2和3s23p1。利用同周期元素的递变规律可知,原子半径:Mg>Al,金属性:Mg>Al,电负性:Al>Mg;第ⅡA族元素的第一电离能比同周期相邻元素的第一电离能大,所以第一电离能:Mg>Al。
(4)短周期元素最高正化合价为+7的元素应为第ⅦA族元素,氟元素无正价,所以该元素为氯元素。


科目:高中地理 来源: 题型:
【题目】(1)A元素原子的核电荷数为8,其原子核内的质子数为___________,该元素原子的二价阴离子中,核外电子数为___________,中子数是9的核素表示为___________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
(3)A、B形成11型化合物的相对分子质量是___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】完全燃烧一定量的乙烯与某烷烃的混合气体后,测得其生成物中气体的质量是反应前混合烃质量的2.86倍,试通过计算确定该气态烷烃的分子式及它在该混合气体中所占的物质的量分数(气体体积和质量均在常温下测定)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】一种有机物的结构简式为:
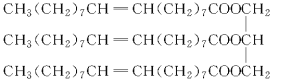
试回答下列问题:
(1)该化合物的种类是________。
A.烯烃 B.酯
C.油脂 D.高分子化合物
(2)该化合物的密度________。
A.比水大 B.比水小
(3)该化合物常温下的状态为________。
A.液体 B.固体 C.气体
(4)与该物质能反应的有________。
A.NaOH溶液
B.碘水
C.乙醇
D.乙酸
E.H2
写出该有机物与选出的化合物反应的化学方程式(任写一个):________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017江苏]铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
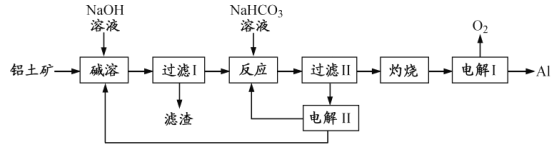
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
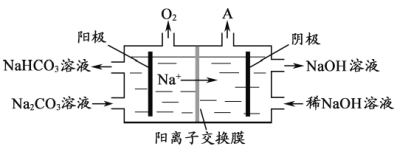
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层p轨道上的电子数等于前一电子层电子总数;X原子最外层的p轨道中有一个轨道填充了2个电子。则
(1)X元素基态原子的电子排布式是__________________,Y原子的价层电子的电子排布图是_______________________。
(2)YX2的分子构型是____________。
(3)YX2分子中,Y原子的杂化类型是__________,一个YX2分子中含________个π键。
查看答案和解析>>
科目:高中地理 来源: 题型:
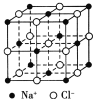
【题目】食盐晶体是由钠离子和氯离子组成的,且均为等距离的交错排列,如图所示。已知食盐的密度是2.2 g/cm3,阿伏加德罗常数为6.02×1023/mol。在食盐晶体中两个距离最近的钠离子间的距离最接近于 厘米(保留整数)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com