
【题目】如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
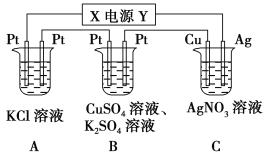
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH的物质的量浓度为________(设电解前后溶液体积无变化)。
【答案】(1)负极
(2)增大 减小 不变
(3)0.025 mol·L1 (4)0.1 mol·L1
【解析】(1)C装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极。
(2)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大,B装置中阴极上先析出铜,当铜离子消耗完后将析出氢气,而阳极上析出氧气,溶液中氢离子浓度增大,C装置中阴极析出银单质,阳极上的银失去电子变成银离子,理论上AgNO3溶液的物质的量浓度不变。
(3)B装置两极上电子转移的数目与C装置中转移的电子数目相同,C装置中转移的电子为![]() =0.02 mol,经判断,B装置中阴极:Cu2++2e===Cu,2H++2e===H2↑,阳极:4OH4e===O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=
=0.02 mol,经判断,B装置中阴极:Cu2++2e===Cu,2H++2e===H2↑,阳极:4OH4e===O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=![]() ,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为:
,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为:![]() =0.025 mol·L1。
=0.025 mol·L1。
(4)A装置的反应为:2KCl+2H2O![]() 2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH)=
2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH)= ![]() =0.1 mol·L1。
=0.1 mol·L1。


科目:高中地理 来源: 题型:
【题目】(7分)某同学用电火花计时器(其打点周期T=0.02 s)来测定自由落体的加速度。
(1)下列器材中,不需要的是_________。(填选项前字母序号)
A.直尺 B.4~6 V交流电源
C.天平 D.纸带
(2)实验中取纸带上的一段,点1、2、3……9为连续打出的,如图所示,由此测得的重力加速度大小为________m/s2。(结果保留三位有效数字)
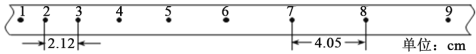
(3)当地的重力加速度大小为9.80 m/s2,测量值与实际值有差异的原因是:_____________________________________。(答出一条即可)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)有剩余气体。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是( )
①粉末中一定有Na2O、Na2O2、NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某课外活动小组按如下图装置探究有关物质的性质。
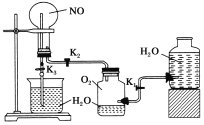
(1)装置的气密性检查;关闭___________,打开________(填“K1”、“K2”或“K3”),若一段时间后__________________,则装置气密性良好。
(2)实验验证NO化学性质的现象是________________,反应的化学方程式为_________________。
(3)关闭K2、打开K3,预期有“喷泉”现象,验证了另一种物质的化学性质。写出反应的化学方程式并标出电子转移的方向和数目____________________。
(4)有关“喷泉”的叙述正确的是(填序号)________。
A.用手(或热毛巾)捂热烧瓶有助于引发“喷泉”
B.“喷泉”的形成说明烧瓶中的气体易溶于水
C.“喷泉”终止时烧瓶中几乎充满液体
D.最终烧瓶中溶液的物质的量浓度约为1/22.4 mol·L-1
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
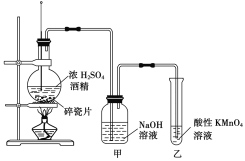
请回答:
(1)实验步骤
①__________________________________;
②在各装置中注入相应的试剂(如图所示);
③______________________________;实验时烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是_________________;装置甲的作用是_________________。若无甲装置,是否也能检验乙烯具有还原性,简述其理由:_________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子为Am+和Bn-,它们的核外电子排布相同,据此判断:
①A和B所属周期数之差为________。
②A和B的核电荷数之差为________(用含m,n的代数式表示)。
(2)A、B两元素,A的原子序数为x,A和B所在周期包含的元素种类数分别为m和n。如果A和B同在第ⅠA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________;如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
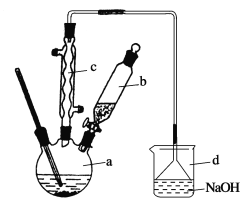
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是______________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为____________________。
(2)有机物A的结构简式为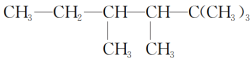
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有________种结构;
②若A是炔烃与氢气加成后的产物,则此炔烃可能有________种结构。
③若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。
a.写出A的该种同分异构体的结构简式:_________________。
b.写出这种烯烃的顺、反异构体的结构简式:____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某元素原子A的L层要比M层少6个电子,它有两种常见的阳离子a和b(其中a的化合价高于b的化合价)。则
(1)a的M层比N层多 个电子;b的L层比M层少 个电子。a的稳定性 (填“大于”或“小于”)b的稳定性。
(2)写出A原子的电子排布式: ;a的最外层的电子排布图是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com