
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:____________________________。
(2)试配平:_______Fe2++_______![]() +_______ ===_______Fe3++_______Cr3++_______H2O
+_______ ===_______Fe3++_______Cr3++_______H2O
(3)若该废水经处理后Cr3+的含量为1×102 mol·m3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm3)。
【答案】(1)2FeS2+7O2+2H2O![]() 2FeSO4+2H2SO4
2FeSO4+2H2SO4
(2)6 1 14 H+ 6 2 7
(3)1×104
【解析】(1)由反应物空气(O2)、水(H2O)、黄铁矿(FeS2)和生成物硫酸亚铁(FeSO4)、常见强酸(可能为H2SO4)可书写化学方程式为2FeS2+7O2+2H2O![]() 2FeSO4+2H2SO4。
2FeSO4+2H2SO4。
(2)根据化合价升降总数相等,确定Fe2+、![]() 的化学计量数分别为6、1,由Fe、Cr原子守恒确定生成物中Fe3+、Cr3+化学计量数分别为6、2,再由电荷守恒,反应物 中补加H+,化学计量数为14,由H原子守恒,生成物H2O的化学计量数为7。
的化学计量数分别为6、1,由Fe、Cr原子守恒确定生成物中Fe3+、Cr3+化学计量数分别为6、2,再由电荷守恒,反应物 中补加H+,化学计量数为14,由H原子守恒,生成物H2O的化学计量数为7。
(3)根据电子守恒,设理论上83.4 kg绿矾可处理该废水x t。
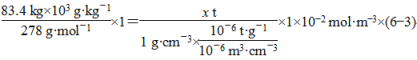
x=1×104。


科目:高中地理 来源: 题型:
【题目】已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为______________________。
(2)写出该烷烃分子的所有同分异构体的结构简式______________________。
(3)上述同分异构体中,在相同条件下沸点最低的是_____________________。(写结构简式)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】以下是表示铁原子和铁离子的3种不同化学用语。
结构示意图 | 电子排布式 | 电子排布图 | |
铁 原 子 |
| 1s22s22p63s23p63d64s2 |
|
铁 离 子 |
| 1s22s22p63s23p63d5 |
|
(1)铁原子最外层电子数为 ,铁在发生化学反应时,参加反应的电子可能是 。
(2)请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )

A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用(从氧化剂、还原剂角度分析)。
①电解水:_____________________________________________________。
②钠和水的反应(2Na+2H2O![]() 2NaOH+H2↑):_______________________________。
2NaOH+H2↑):_______________________________。
③氟气和水反应(2F2+2H2O![]() 4HF+O2):_______________________________。
4HF+O2):_______________________________。
④氯气和水反应(Cl2+H2O![]() HCl+HClO):______________________________。
HCl+HClO):______________________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应体系中还原产物是________;若反应中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在稀硫酸、碳酸钠、二氧化碳、铜片、氢氧化钡、氢氧化钠、生石灰、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应。
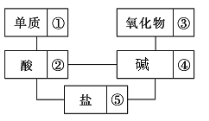
(1)请推断出它们的化学式分别为:
①_______; ②_______; ③________;④________; ⑤_______。
(2)写出下列序号之间反应的化学方程式:
①和②: ____________________________________________;
②和④: ____________________________________________;
②和⑤: ____________________________________________;
④和⑤: ____________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2溶液、盐酸四种无色溶液中的一种,现进行了如图1所示的实验。
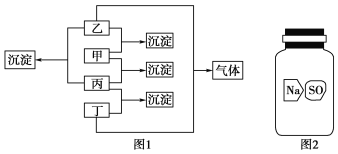
(1)通过上述实验判断出各物质:甲________、乙________、丙________、丁________。写出甲与乙反应的离子方程式______________________。
(2)实验室有一瓶标签破损(如图2所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请说明可能的结论,并给出进一步验证的实验方案(要求:所用试剂只能从甲、乙、丙、丁中选用):__________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。已知:平均反应速率vC=
pC(g)+qD(g)。已知:平均反应速率vC=![]() vA;反应2 min时,A的浓度减少了
vA;反应2 min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=________。
(2)化学方程式中,x=________,y=__________,p=__________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0。(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”“减小”或“不变”),理由是____________________________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是_________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y |
|
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O ![]() Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com