
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。已知:平均反应速率vC=
pC(g)+qD(g)。已知:平均反应速率vC=![]() vA;反应2 min时,A的浓度减少了
vA;反应2 min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=________。
(2)化学方程式中,x=________,y=__________,p=__________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0。(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”“减小”或“不变”),理由是____________________________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是_________________________。
【答案】(1)![]() mol·(L·min)1(3分)
mol·(L·min)1(3分) ![]() mol·(L·min)1(3分)
mol·(L·min)1(3分)
(2)2(2分) 3(2分) 1(2分) 6(2分)
(3)![]() ×100%(3分) (4)<(2分)
×100%(3分) (4)<(2分)
(5)①增大(1分) 体积减小,反应物的浓度增大,因而使反应速率增大(2分)
②减小(1分) 体积减小,气体的压强增大,平衡向气体分子数少的方向(即逆反应方向)移动,因而使反应物转化率减小(2分)
【解析】由 xA(g)+yB(g) ![]() pC(g)+qD(g)
pC(g)+qD(g)
起始(mol) a b 0 0
平衡(mol) a-![]() b-
b-![]() a
a
则x∶y∶q=![]() ∶
∶![]() ∶a=2∶3∶6,而
∶a=2∶3∶6,而![]() =
=![]() =
=![]() =2,故x∶y∶p∶q=2∶3∶1∶6。
=2,故x∶y∶p∶q=2∶3∶1∶6。
(1)vA=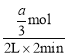 =
=![]() mol·(L·min)-1,vB=
mol·(L·min)-1,vB=![]() vA=
vA=![]() mol·(L·min)-1。
mol·(L·min)-1。
(3)B的转化率为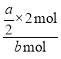 ×100%=
×100%=![]() %。
%。
(4)升温生成物的量减少,即平衡逆向移动,故正反应放热,ΔH<0。
(5)①容器的容积变小,浓度增大,相当于加压,反应速率加快。
②加压平衡向逆反应方向移动,反应物的转化率减小。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中地理 来源: 题型:
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:____________________________。
(2)试配平:_______Fe2++_______![]() +_______ ===_______Fe3++_______Cr3++_______H2O
+_______ ===_______Fe3++_______Cr3++_______H2O
(3)若该废水经处理后Cr3+的含量为1×102 mol·m3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm3)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl ΔH>0。
Fe(OH)3+3HCl ΔH>0。
回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液体中加入MgCl2溶液,产生的现象为_________________________。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入________。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是______________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016上海](1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[![]() ]>[
]>[![]() ]
]
b.[![]() ]>[HC2O4-]>[C2O42-]>[
]>[HC2O4-]>[C2O42-]>[![]() ]
]
c.[H+]>[HC2O4-]>[C2O42-]>[![]() ]
]
d.[H2CO3] >[![]() ]>[HC2O4-]>[
]>[HC2O4-]>[![]() ]
]
(2)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在课堂上,老师演示了金属钠与CuSO4溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现铜单质生成。但某同学想:会不会因生成的铜较少被蓝色沉淀所覆盖而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
假如该同学是你,请你写一张实验准备单交给老师,请求老师提供必需的用品。
(1)实验探究的目的是______________________。
(2)探究所依据的化学原理是________________(用必要的文字和化学方程式表示)。
(3)实验必需仪器:小刀、玻璃片、滤纸、____和____;实验药品:金属钠、____和____。该同学在探究实验中意外地发现生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________,生成该黑色难溶物的原因是________________________________
(用必要的文字和化学方程式表示)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列有关表述中正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有![]() 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+ c(H2CO3)= c(OH-)
C.10 mL 0.10 mol/L CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量。
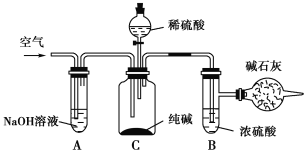
实验过程的主要步骤是:
①准确称取干燥试样x g(x>2),放入广口瓶C中。
②准确称量装有碱石灰的干燥管的质量为y g。
③从分液漏斗中缓缓注入稀硫酸,至不再产生气体为止。
④缓缓鼓入空气数分钟,然后将干燥管取下,准确称量其质量为W g。
根据以上实验,填写下列空格:
(1)装置A的作用是____________________________,如果不用装置A,会导致实验结果偏________(填“大”“小”或“不变”,下同)。
(2)装置B的作用是__________________,如果不用装置B,会导致实验结果偏________。
(3)通入空气的作用是__________________________________________。如果不通入空气,会导致实验结果偏________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com