
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列有关表述中正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有![]() 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+ c(H2CO3)= c(OH-)
C.10 mL 0.10 mol/L CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中地理 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )

A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。已知:平均反应速率vC=
pC(g)+qD(g)。已知:平均反应速率vC=![]() vA;反应2 min时,A的浓度减少了
vA;反应2 min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=________。
(2)化学方程式中,x=________,y=__________,p=__________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0。(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”“减小”或“不变”),理由是____________________________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是_________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知在相同条件下电离常数有如下关系:Ka1(H2CO3)>Ka(HBrO)>Ka2(H2CO3)。下列离子方程式或化学方程式中不正确的是
A.向NaHCO3溶液中滴加少量溴水:![]() +Br2
+Br2![]() HBrO+Br+CO2↑
HBrO+Br+CO2↑
B.向Na2CO3溶液中滴加少量溴水:2![]() +Br2+H2O
+Br2+H2O![]() BrO-+Br-+2
BrO-+Br-+2![]()
C.向NaBrO溶液中通入少量的CO2:CO2+NaBrO+H2O![]() NaHCO3+HBrO
NaHCO3+HBrO
D.向NaBrO溶液中通入足量的CO2:CO2+2NaBrO+H2O![]() Na2CO3+2HBrO
Na2CO3+2HBrO
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某课外活动小组设计以下装置进行实验:
(1)按如图所示装置进行实验,填写有关现象及化学方程式。
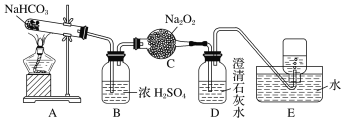
①B中浓硫酸的作用是__________________________________。
②C中发生反应的化学方程式为______________________________________________________。
③D中的现象是___________________________________________。
④E中收集的气体是________。
(2)用如下图所示装置制取纯净的O2。
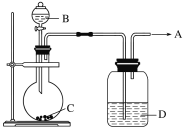
①若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是______________________。
②若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
③洗气瓶(广口瓶)中装的试剂D的作用是_____________________。所制得的气体用________法收集。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为:________________________________。
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_________________________________。
(4)检验Fe3+存在的最佳试剂是____________,现象是______________________________________。
(5)写出Fe与H2O(g)在一定条件下反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y |
|
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O ![]() Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的化学方程式(离子反应需写离子方程式):
(1)Fe2O3(Al2O3)_________________________________________________;
方程式________________________________________________________。
(2)Fe2O3[Fe(OH)3]______________________________________________;
方程式_________________________________________________________。
(3)FeSO4溶液(CuSO4)___________________________________________ __;
方程式_________________________________________________________。
(4)FeCl3溶液(FeCl2)________________________________________________;
方程式________________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】You know in my class some students have trouble grammar while others have difficulty __________ new words.
A. in; remember B. for; to remember
C. on; remembering D. with; remembering
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com