
【题目】在a、b两支试管中分别装入形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:相同点是__________,不同点是________________,原因是______________________________________。
(2)a、b两支试管中生成气体的体积开始时是V(a)___V(b),反应完毕后生成气体的总体积是V(a)________V(b),原因是_____________________________。
【答案】(1)都产生无色气泡(1分) a中反应速率较快(1分)
盐酸是强酸,醋酸是弱酸,盐酸溶液中的c(H+)大(2分)
(2)大于(1分) 等于(1分)
反应开始时,盐酸溶液中所含H+浓度较大,但二者所含H+的总的物质的量相等(2分)
【解析】锌粒与酸反应的实质是Zn与酸电离出的H+发生置换反应产生H2,c(H+)越大,产生H2的速率越快。而在分析产生H2的体积时,要注意醋酸的电离平衡的移动。反应开始时,醋酸产生H2的速率比盐酸慢,因Zn与酸反应的实质是Zn与酸电离出的H+反应,盐酸是强电解质,醋酸是弱电解质,在起始物质的量浓度相同时,盐酸电离出的c(H+)远大于醋酸电离出的c(H+)。反应完毕后,两者产生H2的体积(标准状况)是相等的。因醋酸存在电离平衡CH3COOH![]() CH3COO-+H+,Zn与H+发生反应,c(H+)减小,使醋酸的电离平衡向电离方向移动,继续发生H+与Zn的反应,足量的Zn可使醋酸中的H+全部电离出来与Zn反应生成H2,又因为n(HCl)=n(CH3COOH),因而最终产生H2的量相等。
CH3COO-+H+,Zn与H+发生反应,c(H+)减小,使醋酸的电离平衡向电离方向移动,继续发生H+与Zn的反应,足量的Zn可使醋酸中的H+全部电离出来与Zn反应生成H2,又因为n(HCl)=n(CH3COOH),因而最终产生H2的量相等。


科目:高中地理 来源: 题型:
【题目】常温下,有两种溶液:①0.1 mol·L1 CH3COOH溶液 ②0. 1 mol·L1 CH3COONa溶液。
(1)溶液①的pH______7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是__________________________________________________。
(2)溶液②呈______性(填“酸”“碱”或“中”)。其原因是__________________________________
(用离子方程式和适当的叙述说明)。
(3)下列说法正确的是________(填序号)。
a.两种溶液中c(CH3COO)都等于0.1 mol·L1
b.两种溶液中c(CH3COO)都小于0.1 mol·L1
c.CH3COOH溶液中c(CH3COO)小于CH3COONa溶液中c(CH3COO)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:
NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度 (填“增大”“减小”或“不变”,下同),![]() 的浓度 。
的浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,此时溶液中浓度减小的粒子有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】把1.1 g铁、铝混合物溶于200 mL 5 mol·L1盐酸中,反应后盐酸的浓度变为4.6 mol·L1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量;
(2)该混合物中铝、铁的物质的量。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与加入的NaOH的物质的量之间的关系曲线。
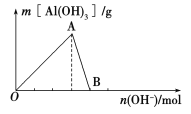
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
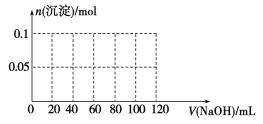
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图表示人体细胞与外界环境之间进行物质交换的过程。A、B、C、D表示四种体液,①②表示有关的物质。请据图回答:

(1)A~D中不属于内环境成分的是[ ] ;[ ] 是体内绝大多数细胞直接生活的环境。
(2)B体液是 ,经过循环它由 汇入C中。B、C的成分相近,两者最主要的差别是 。
(3)C的渗透压大小主要与 的含量有关;其酸碱度保持相对稳定,与它含有的 、HPO42-等离子有关。
(4)如果②代表O2,由体外进入到组织细胞需要 (系统)协助完成;机体维持稳态的主要调节机制是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】 The general manager thought _______ of these problems before he made the final decision.
A. a good many B. a great deal
C. lots D. a plenty
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com