
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: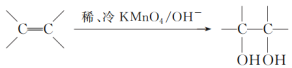 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中地理 来源: 题型:
【题目】如图所示,质量为m=2kg的木块,放在水平地面上,它们之间的动摩擦因数μ=0.5;现对木块施一与水平成θ=37°,大小为F=20N的恒定拉力作用,木块运动4s后撤去力F,已知g=10m/s2,sin37°=0.6.求:
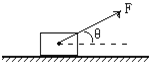
(1)撤去推力F时木块的速度为多大?
(2)撤去推力F后木块还能在水平面上滑行多远?
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某同学用下图所示装置制取氯水并进行相关实验。
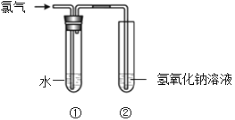
(1)装置②中反应的化学方程式是 。装置②中的NaOH溶液换成下列 也可以起到尾气处理的作用(填字母)。
a.NaCl溶液 b.FeSO4溶液 c.Na2SO3溶液
(2)实验进行一段时间后,装置①中溶液呈黄绿色,由此说明该溶液中一定含有的物质是 (填化学式)。
(3)取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有 性。
(4)已知将氯气通入热的氢氧化钠溶液中,可发生如下反应:Cl2 + NaOH → A + NaClO3 +H2O(未配平)其中,A的化学式是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】根据下表回答问题:
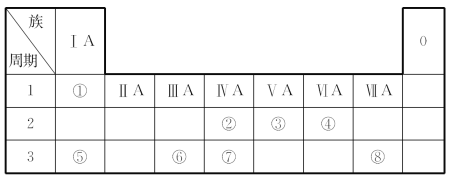
(1)元素⑦在周期表中的位置是___________________。
(2)元素①和⑤的原子序数相差 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式________________。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)________________________,
其中能与元素⑥形成的单质反应的化学方程式为______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素原子最外层电子数为B元素的两倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请完成下列空白:
(1)A的原子结构示意图为____________;A元素的名称为____________。
(2)B的原子结构示意图为____________;B元素的名称为____________。
(3)C的离子结构示意图为____________;C元素的名称为____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
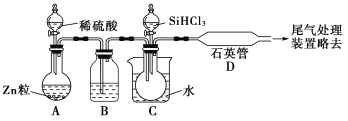
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是__________________________________,装置D不能采用普通玻璃管的原因是___________________________________________,装置D中发生反应的化学方程式为____________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及_______________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
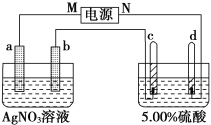
(1)直流电源中,M为________极。
(2)Pt电极上生成的物质是________,其质量为______________________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶________∶________∶________。
(4)AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH________,硫酸的浓度________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。
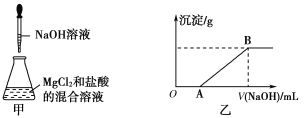
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:
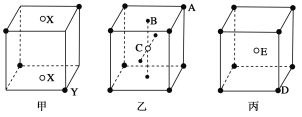
试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com