
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
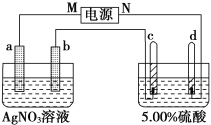
(1)直流电源中,M为________极。
(2)Pt电极上生成的物质是________,其质量为______________________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶________∶________∶________。
(4)AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH________,硫酸的浓度________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
【答案】(1)正 (2)Ag 2.16 (3)2 ![]() 1
1
(4)不变 不变 增大 减小 (5)45.18
【解析】(1)电解5.00%的稀硫酸,实际上是电解其中的水。因此在该电解池中发生反应:2H2O![]() 2H2↑+O2↑,V(H2)∶V(O2)=2∶1。据此可确定d极为阴极,则电源的N极为负极,M极为正极。
2H2↑+O2↑,V(H2)∶V(O2)=2∶1。据此可确定d极为阴极,则电源的N极为负极,M极为正极。
(2)在336 mL气体中,V(H2)=![]() ×336 mL=224 mL,为0.01 mol;V(O2)=
×336 mL=224 mL,为0.01 mol;V(O2)=![]() ×336 mL=112 mL,为0.005 mol。说明电路上有0.02 mol电子转移,因此在b极(Pt、阴极)产生Ag:0.02 mol×108 g·mol1=2.16 g,即0.02 mol的Ag。
×336 mL=112 mL,为0.005 mol。说明电路上有0.02 mol电子转移,因此在b极(Pt、阴极)产生Ag:0.02 mol×108 g·mol1=2.16 g,即0.02 mol的Ag。
(3)n(e)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶![]() ∶1。
∶1。
(4)由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+的物质的量等于Ag电极被氧化给溶液补充的Ag+的物质的量,因此AgNO3溶液的浓度不变,溶液的pH也不变。电解5.00%的硫酸溶液,由于其中的水发生电解,因此硫酸浓度增大,由于H+的浓度增大,故溶液的pH减小。
(5)设原5.00%的硫酸为x g,电解时消耗水0.01 mol×18 g·mol1=0.18 g,则:5.00%x=5.02%(x0.18),解得x=45.18 g。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中地理 来源: 题型:
【题目】1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:
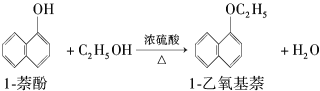
(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________。烧瓶上连接长玻璃管的主要作用是________________。
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________(填序号)。
A.③②④① B.①②③④ C.②①③④
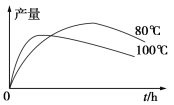
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________、____________。
(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
实验目的 | 实验操作 | 预期现象和结论 |
①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若________,则产品纯净; 若________,则产品不纯 |
②检验经提纯的产品是否含有1萘酚 | ____________ ____________ | 若____________,则含有1萘酚; 若____________,则不含1萘酚 |
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: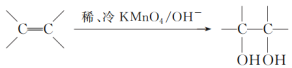 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的43倍, 。
(2)烷烃B的分子中含有200个氢原子, 。
(3)分子中含有26个电子的烷烃C, 。
(4)室温下相对分子质量最大的气态直链烷烃D, 。
(5)0.1 mol烷烃E完全燃烧,消耗标准状况下的O211.2 L, 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请回答下列问题:
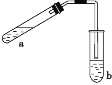
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,加入的操作顺序是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)写出实验中加热试管的目的:① ;② 。
(4)试管b中盛有饱和Na2CO3溶液,其作用是 。
(5)反应结束后,振荡试管b,静置,观察到的现象是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】现以C8H18为原料经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,结合有关知识回答问题:
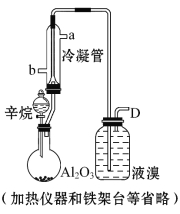
(1)生成乙烯的化学方程式为 , 。
(2)生成1,2-二溴乙烷的化学方程式是 。
(3)使用冷凝管的目的是 ,
冷凝管的进、出水方向为 。
(4)设计三种简单的实验证明广口瓶内发生的是加成反应而不是取代反应:
①第一种: 。
②第二种: 。
③第三种: 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式: (至少写出5个)。
(2)写出用上述元素组成的物质制得A的单质的化学方程式: 、
(3)检验某溶液中是否含有D+,可通过 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是 和 。
(4)写出E的元素符号: ,要证明太阳上是否含有E元素,可采用的方法是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目: ___________________________________________________________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com