
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(1)石英砂、纯碱和石灰石(2分)
(2)①SiO2 + 2C Si + 2CO↑(2分)、SiO2 + 3C
Si + 2CO↑(2分)、SiO2 + 3C SiC + 2CO↑(2分)
SiC + 2CO↑(2分)
②Si + 3HCl SiHCl3 + H2(2分)
SiHCl3 + H2(2分)
(3)蒸馏(1分) H4SiO4(或H2SiO3)、H2、HCl(2分,答不全,少一种扣一分,但有错不给分)
(4)SiHCl3 + H2 Si + 3HCl (2分)
Si + 3HCl (2分)
(5)H2、HCl(2分)
解析试题分析:(1)生产普通玻璃的主要原料有石英砂、纯碱和石灰石
(2)①石英砂的主要成分是SiO2,与C可能的反应有:SiO2 + 2C Si + 2CO↑、SiO2 + 3C
Si + 2CO↑、SiO2 + 3C SiC + 2CO↑
SiC + 2CO↑
②粗硅生成SiHCl3的化学反应方程式为Si + 3HCl SiHCl3 + H2
SiHCl3 + H2
(3)硅的氯化物的熔点相差较大且互溶,所以采用蒸馏的方法可提纯SiHCl3,从元素的种类上分析SiHCl3完全水解的产物有H4SiO4(或H2SiO3)、H2、HCl
(4)还原炉中发生的反应是氢气还原SiHCl3,化学方程式为SiHCl3 + H2 Si + 3HCl
Si + 3HCl
(5)氯碱工业的产品有H2、Cl2、NaOH,所以为上述工艺生产提供部分原料是H2、HCl
考点:考查化工生产中硅元素的利用,生产玻璃的原料、高纯硅的制取,化学方程式中的产物分析


科目:高中化学 来源: 题型:填空题
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在; pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (写离子方程式)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
①酸性气体是 (填化学式)
②X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点。离子交换法是玻璃进行钢化的一种重要方法。将普通的钠钙玻璃在碳酸钾的强化盐(475 ℃)中浸泡3.5小时后即可制得。下图是离子交换法的示意图。
(1)普通玻璃是由石英砂、__________和__________高温熔融而成。
(2)普通玻璃表面产生裂纹后非常容易破碎,清除表面裂纹的物质之一是氢氟酸,写出氢氟酸与玻璃反应的化学方程式________________。
(3)玻璃进行钢化过程中,离子交换是__________(填“物理变化”或“化学变化”)。
(4)在玻璃进行钢化处理时,能否用碳酸氢钾代替碳酸钾,__________(填“能”或“不能”),原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。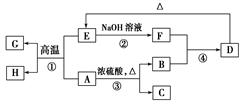
请完成以下填空:
(1)H的名称是________。
(2)E的两种用途是________、________。
(3)反应③的化学方程式是________。
(4)反应④的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一些常见化学反应可用下式表示 A + B → C+D+H2O 其中A为单质 (必要时可加热),请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,则A与B溶液反应的离子方程式为: 。
(2)若C、D均为气体且有一种为红棕色,则B是 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式为: 。
如何稀释B的浓溶液 。
(4) 若A为紫红色的固体,D为无色无味的气体,则A与B溶液反应的离子方程式为: 。若产生标准状况下4.48L的D气体,则被还原的B的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图1是工业上“碱法烟气脱硫法” 示意图,下图2是工业上“石灰→石膏烟气脱硫法”示意图,回答:

已知:
| 试 剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅酸钠是一种重要的无机功能材料,某研究性学习小组设计的利用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的流程如下: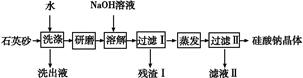
(1)石英砂加水洗涤的目的是 。
研磨后加入NaOH溶液溶解的离子方程式是 。
(2)实验室进行蒸发操作要用到的仪器有铁架台(含铁圈)、 和 。
(3)残渣Ⅰ的成分是 (填化学式)。将残渣Ⅰ溶于盐酸,再加入NaOH溶液得到沉淀,将该沉淀加入到NaClO和NaOH混合溶液中可制得一种优质净水剂,完成反应的离子方程式: + ClO-+ OH- + Cl-+ H2O
+ Cl-+ H2O
(4)按上述流程制得的硅酸钠晶体可表示为Na2O·nSiO2,若石英砂的质量为10.0 g,其中含SiO2的质量分数为90%,最终得到硅酸钠晶体15.2 g,则n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学利用如图装置制NO并进行相关实验探究。
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是 ,在步骤3中可以观察到的现象为 。
(4)在铜丝上绑上石墨的作用是 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。
(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____ 。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________ 。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com