
分析 (1)n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,过氧化钠和水反应生成氢氧化钠和氧气,根据过氧化钠和氧气之间的关系式计算氧气体积;
(2)根据钠原子守恒计算NaOH的物质的量,再根据c=$\frac{n}{V}$计算溶液浓度.
解答 解:(1)过氧化钠的物质的量为:n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,
过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,据此可得关系式2Na2O2----O2,
所以生成的氧气在标准状况下的体积为:$\frac{0.05mol}{2}$×22.4L/mol=0.56L,
答:生成标准状况下氧气的体积为0.56L;
(2)根据钠原子守恒得n(NaOH)=2n(Na2O2)=2×0.05mol=0.1mol,c(NaOH)=$\frac{0.1mol}{0.1L}$=1mol/L,
答:所得溶液中溶质的物质的量浓度为1mol/L.
点评 本题考查了物质的量的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题有利于提高学生的分析能力及化学计算能力.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
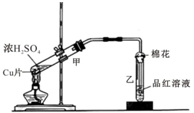 如图为浓硫酸与铜片反应的装置.请回答:
如图为浓硫酸与铜片反应的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、SO42-、Cl- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | H+、K+、CO32-、NO3- | D. | Ag+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置中CCl4的作用是除去产物HBr中混有的Br2蒸气 | |
| B. | 若将液溴改为浓溴水,该反应也能进行 | |
| C. | 通过AgNO3溶液中有淡黄色沉淀产生,说明由苯制溴苯的反应是取代反应 | |
| D. | 该装置中左侧长导管的作用是导气兼冷凝回流 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com