
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
分析 A.催化剂只影响反应速率,不影响化学反应中的能量变化;
B.CO的燃烧为放热反应,其焓变为负值;
C.熵变反应反应前后物质的运动混乱程度,熵值越大,生成物混乱程度越大,越容易反应,相反则不易反应;
D.该反应为可逆反应,平衡时反应物不可能完全转化成生成物.
解答 解:A.对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,可以改变反应速率,但是不影响反应过程中放出的热量,故A错误;
B.CO燃烧为放热反应,则其燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-285.8kJ/mol,故B错误;
C.反应2Mg+CO2=2MgO+C的熵变△S<0,从熵变角度分析,该反应不能自发进行,故C正确;
D.在密闭容器中发生反应2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,说明消耗2molHI吸收14.9kJ热量;若投入NA个HI分子,HI的物质的量为1mol,应用该反应为可逆反应,则反应平衡时消耗HI的物质的量小于1mol,吸热小于7.45kJ,故D错误;
故选C.
点评 本题考查了反应热与焓变,题目难度中等,涉及燃烧热、反应热计算、反应自发进行判断等知识,明确化学反应与能量变化的关系为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 将58.5gNaC1溶解于1L水中配成的溶液 | |
| B. | 将80gSO3溶于水并配成1L溶液 | |
| C. | 将100mI.0.5mol•L-1NaNO3溶液加热蒸发掉50g水之后的溶液 | |
| D. | 含2molK+的K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
某非金属单质A和氧气发生化合反应生成B。为气体,其体积是反应掉氧气体积的两倍(同温、同压)。以下对B的分子组成的推测一定正确的是( )
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
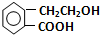 ,它可通过不同化学反应分别制得B、C、D三种物质.
,它可通过不同化学反应分别制得B、C、D三种物质.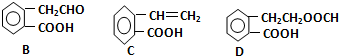
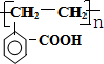 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀铜时用待镀的金属制品作阳极、铜作阴极 | |
| B. | AlCl3熔点低,电解熔融AlCl3冶炼铝更节能 | |
| C. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| D. | 氯碱工业实际是指电解饱和食盐水的工业生产 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com