
【题目】下列过程,观察不到颜色变化的是( )
A.NO气体暴露在空气中
B.往FeCl3溶液中滴入KSCN溶液
C.Cl2通过湿润的有色布条
D.往NaOH溶液中通入CO2
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
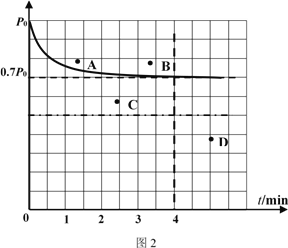
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
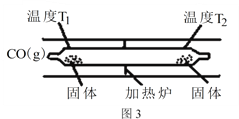
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于化合反应的是
A. KCl+AgNO3===KNO3+AgCl↓ B. 2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
C. CaCO3![]() CaO+CO2↑ D. 2Mg+O2
CaO+CO2↑ D. 2Mg+O2![]() 2MgO
2MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在指定溶液中可能大量共存的是( )
A.Na+、Fe2+、ClO-、SO42-B.Fe3+、NH4+、NO3-、SCN-
C.Na+、Cl-、SiO32-、NO3-D.HCO3-、K+、Na+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。

(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述,错误的是( )
A. 镁是第IIA族元素
B. 第IA族元素全部是金属元素
C. O族中无金属元素
D. 第3周期中既有金属元素又有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如下图所示。
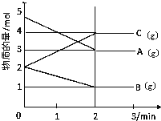
(1)则该反应的化学方程式为__________________;
(2)反应开始至2分钟时,能否用C表示反应速率?_____(填能或不能)。若能,其反应速率为 ;若不能,则其原因为__________;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】60 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后被还原的硫酸的物质的量为( )
A. 1.08 molB. 0.54 mol
C. 在0.54~1.08 mol之间D. 小于0.54 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com