
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
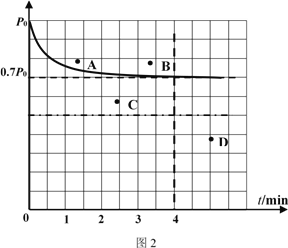
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
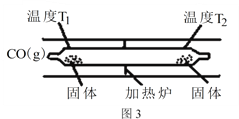
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
【答案】 10Fe0.9O+CO2![]() 3Fe3O4+C 0.4 -270 52g·L-1 6.75(mol·L-1)-2 D < CO
3Fe3O4+C 0.4 -270 52g·L-1 6.75(mol·L-1)-2 D < CO
【解析】分析:(1)根据反应物和生成物书写化学方程式;根据氧元素的化合价变化计算;
(2)①根据ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量计算;
②密度是混合气体的质量和容器容积的比值。根据4min时的压强之比计算气体的物质的量之比,进而计算平衡常数;结合反应特点和外界条件对平衡状态的影响分析;
(3)根据温度对平衡状态的影响以及参加反应的物质分析。
详解:(1)过程①中反应物是二氧化碳和Fe0.9O,生成物是碳和四氧化三铁,则反应的化学方程式是10Fe0.9O+CO2![]() 3Fe3O4+C;在过程②中氧元素化合价从-2价升高到0价,失去2个电子,则每产生0.1molO2,转移电子0.4mol。
3Fe3O4+C;在过程②中氧元素化合价从-2价升高到0价,失去2个电子,则每产生0.1molO2,转移电子0.4mol。
(2)①根据表中数据可知反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=(2×745+4×436-4×413-2×2×463)kJmol-1=-270kJmol-1
CH4(g)+2H2O(g)△H=(2×745+4×436-4×413-2×2×463)kJmol-1=-270kJmol-1
②反应前后均是气体,根据质量守恒定律可知4 min时容器内气体的密度为![]() ;4min时压强不再发生变化,反应达到平衡状态,则
;4min时压强不再发生变化,反应达到平衡状态,则
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
起始量(mol) 1 4 0 0
转化量(mol) x 4x x 2x
平衡量(mol) 1-x 4-4x x 2x
压强之比是物质的量之比,则![]() ,解得x=0.75。容器的容积是1L,则温度T1下,该反应的化学平衡常为
,解得x=0.75。容器的容积是1L,则温度T1下,该反应的化学平衡常为![]() 。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则相当于是在原平衡的基础上减小压强,平衡向逆反应方向进行,且反应速率减小,到达平衡的时间增加,则反应重新达到平衡时对应体系内的压强的点是D点。
。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则相当于是在原平衡的基础上减小压强,平衡向逆反应方向进行,且反应速率减小,到达平衡的时间增加,则反应重新达到平衡时对应体系内的压强的点是D点。
(3)在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。由于生成镍的反应是吸热反应,升高温度有利于生成Ni,则温度T1<T2;由于CO在左端是反应物,而在右端生成镍的同时又产生CO,因此上述反应体系中循环使用的物质为CO。


科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________溶解,再向该溶液中加入适量的__________溶液,如有____________现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________(填装置序号)
②实验中如观察到装置A中品红溶液______,装置B BaCl2溶液中__________,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________(用离子方程式表示〕。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.常温常压下,11.2LCO2所含分子数为0.5NA
C.H2SO4 的摩尔质量为98 g
D.6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
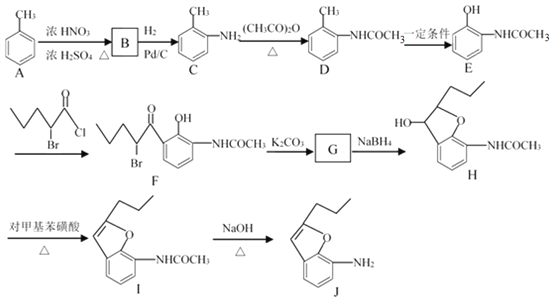
【题目】合成有机化合物J的流程如下所示。
回答下列问题:
(1)B的名称为______。
(2)C![]() D的反应类型为______,H
D的反应类型为______,H![]() I的反应类型为______。
I的反应类型为______。
(3)同时满足下列条件D的同分异构体数目为______。
①能发生银镜反应;②分子结构中含有—NH2;③苯环上有两个取代基,且苯环上的一氯代物有2种。若满足①②条件,且苯环上的一氯代物只有1种,则其中一种物质的结构简式为______。
(4)G的分子式为C13H15O3N,由F生成G的化学方程式为______。
(5)已知:苯胺(![]() )易被氧化,请以乙苯和(CH3CO)2O为原料制备
)易被氧化,请以乙苯和(CH3CO)2O为原料制备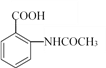 ,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)_________。
,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应,属于氧化还原反应的是( )
A. CaCO3![]() CaO + CO2 ↑ B. 2NaOH +CO2
CaO + CO2 ↑ B. 2NaOH +CO2![]() Na2CO3+ H2O
Na2CO3+ H2O
C. NaOH+HCl==NaCl+H2O D. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月16日新闻报道“阿斯利康哮喘”新药获批上市,哮喘率降低近51%,有机物Z可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示
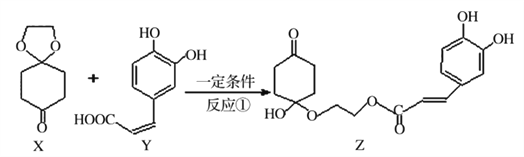
(1)化合物X的有_______种化学环境不同的氢原子。
(2)下列说法正确的是_______.
A.X是芳香化合物 B.Ni催化下Y能与5molH2加成
C.Z能发生加成、取代及消去反应 D. lmolZ最多可与5molNaOH反应
(3)Y与过量的溴水反应的化学方程式为_________。
(4)X可以由_______(写名称)和M(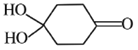 ) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如:
) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如: 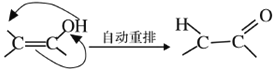 )。
)。
(5)Y也可以与环氟丙烷 )发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
)发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
(6) 可由
可由 和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用
和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用![]() 为原料合成
为原料合成 ,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:
,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:  )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。根据要求回答下列相关问题:
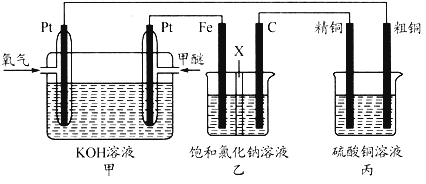
(1)通入氧气的电极为_____(填“正极”或“负极”),写出负极的电极反应式_____.
(2)铁电极为_____(填“阳极”或“阴极”),石墨电极的电极反应式为_____.
(3)反应一段时间后,乙装置中生成NaOH主要在_____(填“铁极”或“石墨极”)区.
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_____,反应一段时间,硫酸铜溶液浓度将_____(填“增大”“减小”或“不变”).
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下的体积为_____;丙装置中阴极析出铜的质量为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com