
【题目】下列叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.常温常压下,11.2LCO2所含分子数为0.5NA
C.H2SO4 的摩尔质量为98 g
D.6.02×1022个H2SO4分子的质量为9.8 g
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
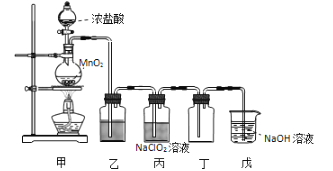
(1)甲装置中圆底烧瓶内发生反应的化学方程式是____________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO2-、ClO3-,该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量NaOH溶液的烧杯中通入CO2气体,然后向该溶液中逐滴加入1mol/L盐酸.所加入盐酸溶液的体积与产生二氧化碳气体体积(标准状况)的关系如图所示:
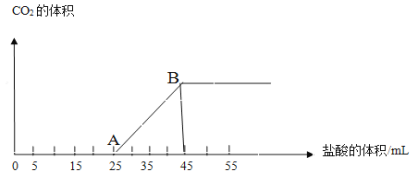
(1)写出OA段所发生反应的离子方程式_____。
(2)当加入35mL盐酸时,所产生的二氧化碳的体积(标准状况)是_____mL。
(3)通入CO2气体后,溶液中所含溶质及溶质的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 分类法对研究化学物质和化学反应有重要的意义,请完成下列问题。今有七种物质: ①铝线 ②熔化的KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,其中能导电的物质是_______,属于电解质的是____,属于非电解质的是__。写出⑥与足量碳酸氢钠溶液反应的离子方程式:_____。
Ⅱ.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 _____________________________。
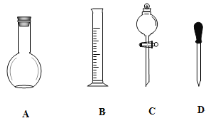
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取NaOH固体的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)若用18.4mol/L的浓硫酸进行配制,所需该浓硫酸的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、CO32-、SO42-中的几种。
①若加入锌粒,最终产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则下列说法正确的是( )
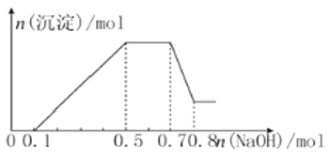
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2 mol
C. 溶液中一定不含CO32-,可能含有SO42-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
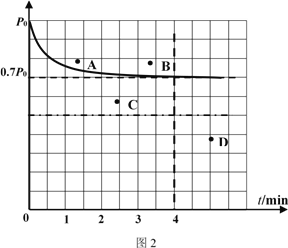
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
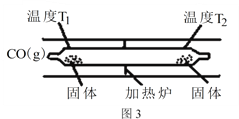
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1).用双线桥法分析上述反应(只需标出电子得失的方向和数目)__________。
(2).上述反应中氧化剂是__________,氧化产物是__________。
(3).上述反应中氧化剂与还原剂的物质的量之比为__________。
(4).若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
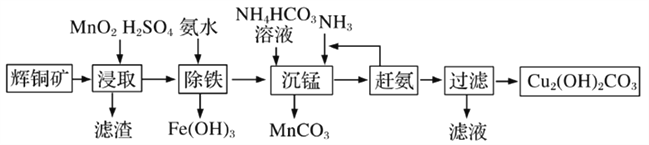
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________。
③写出“沉锰”反应时离子方程式___________。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
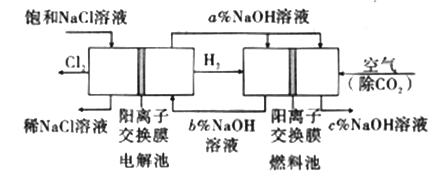
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
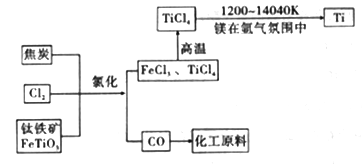
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com