
����Ŀ��ͭ���仯�����������������й㷺Ӧ��
(1)��ҵ���Ի�ͭ��(CuFeS2)Ϊԭ�ϣ����û�������������ͭ���м���̻ᷢ����Ӧ:2Cu2O+Cu2S![]() 6Cu+SO2���÷�Ӧ����������________����֤��Ӧ������������SO2�ķ�����___________��
6Cu+SO2���÷�Ӧ����������________����֤��Ӧ������������SO2�ķ�����___________��
(2)������ͭ˿����������ϡ�����У��¶ȿ�����50�棬����H2O2����Ӧһ��ʱ������µ�60�棬�ٷ�Ӧһ��ʱ�����Ƶ�����ͭ���¶ȿ�����50�桫60�������ԭ����˼ӿ췴Ӧ�����⣬����___________����CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuC1������д������CuCl�����ӷ���ʽ______________��
(3)��ʽ̼��ͭ���л��������̻���������ϡ�ũҩ�������й㷺��Ӧ�á�ij�����Ի�ͭ��(��Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2������)Ϊԭ���Ʊ���ʽ̼��ͭ����������:
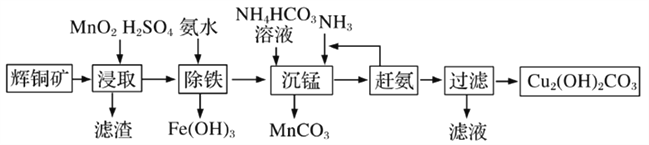
�ٻ�ͭ���ڽ�ȡǰҪ��������飬����ĺô���___________��
�ڽ�ȡ�����еõ�һ�ֵ��ʣ�д����ȡʱ��Ҫ��Ӧ�Ļ�ѧ����ʽ___________��
��д�������̡���Ӧʱ���ӷ���ʽ___________��
�ܡ���������һ����Ӧ��25����У����백ˮ������ҺpHΪ4����Һ��ͭ�������Ũ�Ȳ�����_________mol/L��(��֪Ksp[Cu(OH)2]=2.2��10-20)
���𰸡� Cu2S��Cu2O ������ͨ��Ʒ����Һ����Һ��ɫ�����Ȼָ�ԭɫ ͬʱ��ֹH2O2�ֽ� 2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+ SO42-+2H+ ����߽�ȡ���ʺͽ�ȡ�� Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O Mn2++HCO3-+NH3 = MnCO3��+NH4+ 2.2
2CuCl��+ SO42-+2H+ ����߽�ȡ���ʺͽ�ȡ�� Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O Mn2++HCO3-+NH3 = MnCO3��+NH4+ 2.2
����������1��2Cu2O+Cu2S![]() 6Cu+SO2�����÷�Ӧ��ͭ�Ļ��ϼ���+1�۱�Ϊ0�ۣ�ͭԪ���ڸ÷�Ӧ�еõ��ӻ��ϼ۽��ͣ����Ը÷�Ӧ�е���������Cu2O��Cu2S��SO2����Ư���ԣ���ʹƷ����Һ��ɫ�����Ȼָ�ԭɫ�����Խ�����ͨ��Ʒ����Һ��Һ��ɫ�����Ȼָ�ԭɫ��
6Cu+SO2�����÷�Ӧ��ͭ�Ļ��ϼ���+1�۱�Ϊ0�ۣ�ͭԪ���ڸ÷�Ӧ�еõ��ӻ��ϼ۽��ͣ����Ը÷�Ӧ�е���������Cu2O��Cu2S��SO2����Ư���ԣ���ʹƷ����Һ��ɫ�����Ȼָ�ԭɫ�����Խ�����ͨ��Ʒ����Һ��Һ��ɫ�����Ȼָ�ԭɫ��
��2������ͭ˿����������ϡ��������ͭ˿��ϡ�����Ӧ��������H2O2������˫��ˮ����ǿ�������������������¿���ͭ�����ɶ���ͭ��������Ӧ�����ӷ���ʽΪ��Cu+2H++H2O2=Cu2++2H2O����ΪH2O2�ڽϸ��¶�ʱ���ֽ��������¶ȿ�����50��-60�������Է�ֹH2O2�ֽ�����CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ����������CuCl������ͭԪ�صĻ��ϼ۽�������SO32-��Cu2+����ΪSO42-����Ӧ���Cu2+��Cl-��SO32-�⣬����H2O��������H+�����ݵ�ʧ�����غ��ԭ���غ���ƽ����2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+ SO42-+2H+�ʴ�Ϊ��ͬʱ��ֹH2O2�ֽ���2Cu2++2Cl-+SO32-+H2O
2CuCl��+ SO42-+2H+�ʴ�Ϊ��ͬʱ��ֹH2O2�ֽ���2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+ SO42-+2H+��
2CuCl��+ SO42-+2H+��
��3�������ʱ��ͨ�������ʯ���������¶Ȼ��߽��н�����������Ũ�ȣ���������߽�ȡ���ʣ��ʴ�Ϊ����߽�ȡ���ʣ�
�ڷ�Ӧ���Ƕ������̡���ͭ�����ᣬ��������S������ͭ�������̣���Ӧ�ķ���ʽΪ2MnO2+Cu2S+4H2SO4=S��+2CuSO4+2MnSO4+4H2O���ʴ�Ϊ��2MnO2+Cu2S+4H2SO4=S��+2CuSO4+2MnSO4+4H2O��
�ۡ����̡���Mn2+�����̣���Ҫ��ʹMn2+���ɳ���MnCO3����Ӧ�����ӷ���ʽΪMn2++HCO3-+NH3 = MnCO3��+NH4+ ���ʴ�Ϊ��Mn2++HCO3-+NH3 = MnCO3��+NH4+��
�ܸ���pHΪ4����֪��c(OH-)=10-10mol/L���ٸ���Ksp[Cu(OH)2]֪��c(Cu2+)=Ksp/[c2(OH-)]=![]() mol/L=2.2mol/L�����Դ�Ϊ2.2��
mol/L=2.2mol/L�����Դ�Ϊ2.2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�ɢϵ��˵������ȷ����(����)
A.���ܷ��������ЧӦ�ķ�ɢϵ���Ȼ�����Һ��ˮ��
B.���������(��������η۳�)�γ����ܽ��������ཡ����Σ������
C.����ķ�ɢ�����ӵ�ֱ��Ϊ1��10 nm
D.�Ȼ�����Һ��������������ı����������������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.Ħ���ǹ��ʵ�λ�����߸�����������֮һ
B.���³�ѹ�£�11.2LCO2����������Ϊ0.5NA
C.H2SO4 ��Ħ������Ϊ98 g
D.6.02��1022��H2SO4���ӵ�����Ϊ9.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ������������ԭ��Ӧ����( )
A. CaCO3![]() CaO + CO2 �� B. 2NaOH +CO2
CaO + CO2 �� B. 2NaOH +CO2![]() Na2CO3+ H2O
Na2CO3+ H2O
C. NaOH+HCl==NaCl+H2O D. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
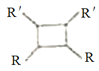
����Ŀ����ͼΪCaF2��H3BO3(��״�ṹ�����ڵ�H3BO3����ͨ��������)������ͭ���־���Ľṹʾ��ͼ����ش��������⣺
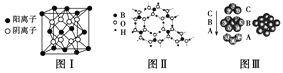
(1)ͼ����ʾ��CaF2��������Ca2������ҵȾ����F����Ϊ________��ͼ����δ��ŵ�ͭԭ���γɾ������Χ����ڵ�ͭԭ����Ϊ________��
(2)ͼ����ʾ�����ʽṹ�������ܲ��Ѵ�8���ӽṹ��ԭ����________��H3BO3��������ԭ�Ӹ����뼫�Լ�������Ϊ________��
(3)����ͭ���кܺõ���չ�ԡ����紫���ԣ��Դ�������Ľ�������________���ۡ�
(4)���־������۵���͵���________���侧�������ۻ�ʱ���˷�����֮��������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��11��16�����ű�������˹������������ҩ�������У������ʽ��ͽ�51%���л���Z����������������ϵͳ�Ժ���Ǵ��ȡ���ϳ�·������ͼ��ʾ
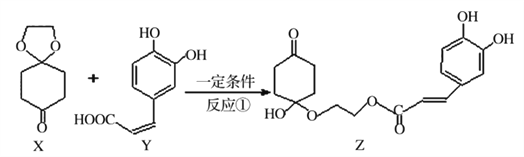
(1)������X����_______�ֻ�ѧ������ͬ����ԭ�ӡ�
(2)����˵����ȷ����_______.
A.X�Ƿ��㻯���� B.Ni����Y����5molH2�ӳ�
C.Z�ܷ����ӳɡ�ȡ������ȥ��Ӧ D. lmolZ������5molNaOH��Ӧ
(3)Y���������ˮ��Ӧ�Ļ�ѧ����ʽΪ_________��
(4)X������_______(д����)��M(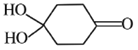 ) ���Ӽ���ˮ���ã�һ�������£�M����1����OH����ȥ��Ӧ�õ��ȶ�������N (����ʽΪC6H8O2)����N�Ľṹ��ʽΪ_____(��֪ϩ��ʽ���ȶ����ᷢ���������ţ�����:
) ���Ӽ���ˮ���ã�һ�������£�M����1����OH����ȥ��Ӧ�õ��ȶ�������N (����ʽΪC6H8O2)����N�Ľṹ��ʽΪ_____(��֪ϩ��ʽ���ȶ����ᷢ���������ţ�����: 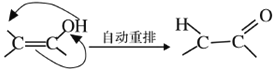 )��
)��
(5)YҲ�����뻷������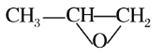 )�������Ʒ�Ӧ�ٵķ�Ӧ����������Ľṹ��ʽΪ_________(дһ��)��Y��ͬ���칹��ܶ��֣������б������������ж���ȡ����(�ҷ��ǻ���λ�ú���Ŀ������)����������ͬ���칹����_____�֡�
)�������Ʒ�Ӧ�ٵķ�Ӧ����������Ľṹ��ʽΪ_________(дһ��)��Y��ͬ���칹��ܶ��֣������б������������ж���ȡ����(�ҷ��ǻ���λ�ú���Ŀ������)����������ͬ���칹����_____�֡�
(6)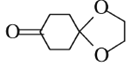 ����
���� ���л���H���Ӽ���ȥһ����ˮ���ã���H������Ϊ________��ͨ������
���л���H���Ӽ���ȥһ����ˮ���ã���H������Ϊ________��ͨ������![]() Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ� ���������Ŀ·��ͼ��Ƹúϳ�·��(���Լ���ѡ) _______��(�ϳ�·�߳��õı�ʾ��ʽΪ:
���������Ŀ·��ͼ��Ƹúϳ�·��(���Լ���ѡ) _______��(�ϳ�·�߳��õı�ʾ��ʽΪ:  )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ��ˮ | NaBr | ����KI��Һ | �����ԣ�Cl2>Br2>I2 | |
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | Br2�ı���Һ | ��м | AgNO3��Һ | �����嵥���������������� ����ȡ����Ӧ | |
D | ���� | Na2SO3 | KMnO4��Һ | SO2��ʹKMnO4��Һ��ɫ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����������һ��ֲ���к��п������õĻ�����M����֪M�ĺϳ�·������ͼ��ʾ:
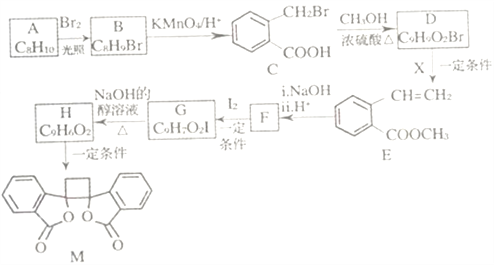
��֪:i.RCH2Br![]() R-HC=CH-R'��
R-HC=CH-R'��
ii.R-HC=CH-R'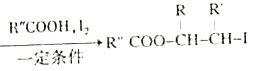 ��
��
iii.R-HC=CH-R'![]()
 (����R��R'��R"�����⡢������)��
(����R��R'��R"�����⡢������)��
(1)A�Ļ�ѧ����Ϊ_______��D�����������ŵ�������______����H����M�ķ�Ӧ����Ϊ_____��
(2)�����Ƚ��ķ�������������������л���ṹ������
�ٿ�����_______(����ס���������ס��˴Ź�������)���C����Է���������
�ڲⶨB�Ľṹ:B�ĺ˴Ź���������ʾΪ_____��塣
(3)1molM������NaOH��Һ��Ӧ������_____molNaOH��
(4)X�ĽṹʽΪ_____��F�Ľṹ��ʽΪ______ ��
(5)��C����H�Ļ�ѧ����ʽΪ__________��
(6)��������������B��ͬ���칹�干______��(�����������칹)��
�ٷ����廯���� ����E������ͬ������ ���ܷ���������Ӧ ������������ˮ��������Ȼ�����Һ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ������������������A��Bͬ���ڣ���̬��AB2��������C��Eԭ�Ӷ���һ��δ�ɶԵ��ӣ�C+��E-��һ�����Ӳ㣬Eԭ�ӵõ�һ�����Ӻ�3p���ȫ������D�����������D����������Ϊ40%���Һ���������������������FΪ��ɫ���ʣ���F+��F2+�������ӡ��ش��������⣺
��1��Ԫ�ص縺�ԣ�D____E (�������)��
��2��B��C�����۵�B_____C(�������)��
��3��AE4��Aԭ���ӻ������ʽΪ��________�ӻ������̬��������Ϊ_____________��
��4���⻯��ķе㣺B��D�ߵ�ԭ��______________��
��5��F�ĺ�������Ų�ʽΪ____________________________����F������������μ��백ˮ�Ȳ���������������ܽ�Ϊ����ɫ��Һ�������Ҵ�����������ɫ���壬�þ���Ļ�ѧʽΪ_______�����й��ڸþ�������˵������ȷ����_____________________��
A�������Ҵ���Ŀ���ǽ����ܼ��ļ��ԣ���ʹ��������
B��F��NH3֮��Ļ�ѧ��Ϊ���Ӽ�
C��������ᄃ���У�N����λԭ�ӣ�NH3Ϊ������
D����������Nԭ�����г�Ϊƽ�������Σ�������F������sp3�ӻ�
E����þ����ˮ��Һ�м���ŨBaCl2��Һ�а�ɫ��������
��6��Ԫ��X��ij��̬������Xn-�����е������ó���K��L���Ӳ㣬CnX�������С�ṹ��ԪΪ�����壬�ṹ��ͼ��ʾ���þ�����ÿ��Xn-��________���Ⱦ����C+���Ӱ�Χ����֪�þ�����ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA��CnX��Ħ������ΪM g/mol��C+��Xn-�����̾�����_____________nm�����г�����ʽ���ɣ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com