
【题目】我国北方生长的一种植物中含有抗菌作用的化合物M,已知M的合成路线如下图所示:
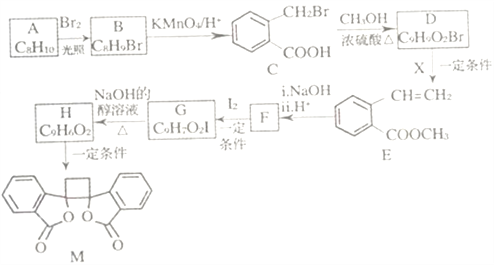
已知:i.RCH2Br![]() R-HC=CH-R';
R-HC=CH-R';
ii.R-HC=CH-R'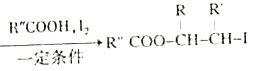 ;
;
iii.R-HC=CH-R'![]()
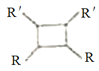 (以上R、R'、R"代表氢、烃基等)。
(以上R、R'、R"代表氢、烃基等)。
(1)A的化学名称为_______,D中所含官能团的名称是______。由H生成M的反应类型为_____。
(2)运用先进的分析仪器,极大改善了有机物结构鉴定。
①可利用_______(填“质谱”“红外光谱”或”核磁共振氢谱)测得C的相对分子质量。
②测定B的结构:B的核磁共振氢谱显示为_____组峰。
(3)1molM与足量NaOH溶液反应,消耗_____molNaOH。
(4)X的结构式为_____,F的结构简式为______ 。
(5)由C生成H的化学方程式为__________。
(6)符合下列条件的B的同分异构体共______种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
【答案】 邻二甲苯 溴原子、酯基 加成反应 质谱 6 2 ![]()

 19
19
【解析】分析:B发生氧化反应生成C,根据C的结构简式结合B的分子式可知B的结构简式为 。A发生取代反应生成B,则A的结构简式为
。A发生取代反应生成B,则A的结构简式为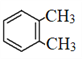 。C与甲醇发生酯化反应生成D,D的结构简式为
。C与甲醇发生酯化反应生成D,D的结构简式为 。根据已知信息i可知D与X反应生成E,根据E和D的结构简式可知X是甲醛,E发生水解反应并酸化后生成F为
。根据已知信息i可知D与X反应生成E,根据E和D的结构简式可知X是甲醛,E发生水解反应并酸化后生成F为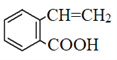 ,根据已知信息ii可知G的结构简式为
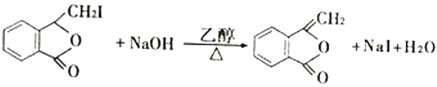
,根据已知信息ii可知G的结构简式为 ,G在氢氧化钠的醇溶液中发生消去反应生成H为
,G在氢氧化钠的醇溶液中发生消去反应生成H为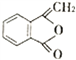 ,H发生已知信息iii的反应生成M,据此解答。
,H发生已知信息iii的反应生成M,据此解答。
详解:(1)A的结构简式为 因此A的化学名称为邻二甲苯;D的结构简式为
因此A的化学名称为邻二甲苯;D的结构简式为 ,D中所含官能团的名称是溴原子、酯基。根据已知信息iii可判断由H生成M的反应类型为加成反应。
,D中所含官能团的名称是溴原子、酯基。根据已知信息iii可判断由H生成M的反应类型为加成反应。
(2)①可利用质谱法可测得C的相对分子质量。
②B的结构简式为 ,因此B的核磁共振氢谱显示为6组峰。
,因此B的核磁共振氢谱显示为6组峰。
(3)M分子中含有2个酯基,则1molM与足量NaOH溶液反应,消耗2molNaOH。
(4)X是甲醛,结构式为![]() ,F的结构简式为
,F的结构简式为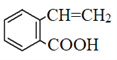 。
。
(5)根据以上分析可知由C生成H的化学方程式为 。
。
(6)①芳香族化合物,含有苯环;②与E具有相同官能团,即含有碳碳双键和酯基;③能发生银镜反应,说明是甲酸形成的酯基;④酸性条件下水解产物遇氯化铁溶液显紫色,说明是酚羟基形成的酯基,因此如果苯环上含有2个取代基,应该是-OOCH和-CH=CHCH3或-OOCH和-CH2CH=CH2或-OOCH和-C(CH3)=CH2,均有邻间对三种。如果含有3个取代基,应该是-CH=CH2、-CH3、-OOCH,有10种结构,共计是19种。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ. 分类法对研究化学物质和化学反应有重要的意义,请完成下列问题。今有七种物质: ①铝线 ②熔化的KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,其中能导电的物质是_______,属于电解质的是____,属于非电解质的是__。写出⑥与足量碳酸氢钠溶液反应的离子方程式:_____。
Ⅱ.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 _____________________________。
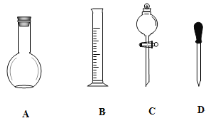
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取NaOH固体的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)若用18.4mol/L的浓硫酸进行配制,所需该浓硫酸的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
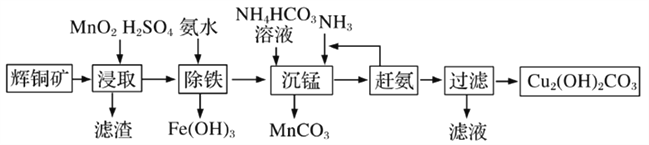
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________。
③写出“沉锰”反应时离子方程式___________。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
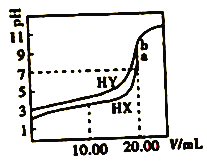
A. 水解常数:X->Y-
B. a、b两点溶液混合后:c(HX)+c(HY)+c(H+)=c(OH-)
C. pH=7时,c(Y-)>c(X-)
D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式中正确的是( )
A. 向氯化钙溶液中通入CO2:CaCl2+CO2+H2O=CaCO3↓+2HCl
B. 铁跟盐酸反应:Fe+2HCl=FeCl2+H2↑
C. NaHCO3溶液的电离方程式:NaHCO3=Na++H+ +CO32-
D. 向沸水中滴加 FeCl3 溶液制备Fe(OH)3 胶体:FeCl3+3H2O=Fe(OH)3↓+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
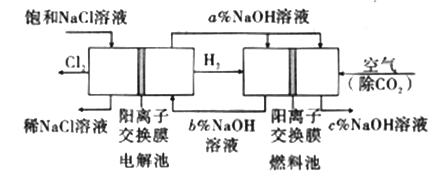
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
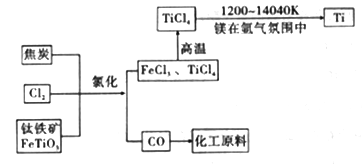
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com