
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
【答案】B
【解析】分析:根据装置图,a电极为阳极,b电极为阴极,电子流向:电源负极→b电极,a电极→电源正极;根据放电顺序,阳极电极反应式为2H2O-4e-=O2↑+4H+;电路中通过3mol电子,阳极室产生3molH+,在产品室中发生的反应为B(OH)4-+H+=H3BO3+H2O,电路中通过3mol电子时可得到3molH3BO3;阳极室生成的H+穿过A膜进入产品室,A膜为阳膜,B(OH)4-穿过阴膜进入产品室,Na+穿过B膜进入阴极室,B膜为阳膜,根据阴、阳极得失电子相等,穿过A膜和B膜的离子数相同。
详解:根据装置图,a电极与直流电源的正极相连,a电极为阳极,b电极与直流电源的负极相连,b电极为阴极。A项,电子流向:电源负极→b电极,a电极→电源正极,A项错误;B项,根据放电顺序,阳极电极反应式为2H2O-4e-=O2↑+4H+,B项正确;C项,当电路中通过3mol电子时,阳极室产生3molH+,3molH+穿过A膜进入产品室,B(OH)4-穿过阴膜进入产品室,产品室中发生的反应为B(OH)4-+H+=H3BO3+H2O,3molH+产生3molH3BO3,C项错误;D项,阳极室生成的H+穿过A膜进入产品室与B(OH)4-反应,A膜为阳膜,B(OH)4-穿过阴膜进入产品室,Na+穿过B膜进入阴极室,B膜为阳膜,根据放电顺序,阴极电极反应式为2H2O+2e-=H2↑+2OH-,根据阴、阳极得失电子相等,穿过A膜和B膜的离子数相等,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列化学反应,属于氧化还原反应的是( )
A. CaCO3![]() CaO + CO2 ↑ B. 2NaOH +CO2
CaO + CO2 ↑ B. 2NaOH +CO2![]() Na2CO3+ H2O
Na2CO3+ H2O
C. NaOH+HCl==NaCl+H2O D. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方生长的一种植物中含有抗菌作用的化合物M,已知M的合成路线如下图所示:
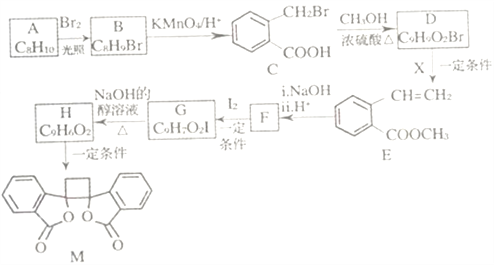
已知:i.RCH2Br![]() R-HC=CH-R';
R-HC=CH-R';
ii.R-HC=CH-R'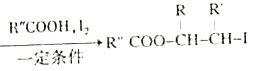 ;
;
iii.R-HC=CH-R'![]()
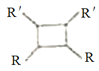 (以上R、R'、R"代表氢、烃基等)。
(以上R、R'、R"代表氢、烃基等)。
(1)A的化学名称为_______,D中所含官能团的名称是______。由H生成M的反应类型为_____。
(2)运用先进的分析仪器,极大改善了有机物结构鉴定。
①可利用_______(填“质谱”“红外光谱”或”核磁共振氢谱)测得C的相对分子质量。
②测定B的结构:B的核磁共振氢谱显示为_____组峰。
(3)1molM与足量NaOH溶液反应,消耗_____molNaOH。
(4)X的结构式为_____,F的结构简式为______ 。
(5)由C生成H的化学方程式为__________。
(6)符合下列条件的B的同分异构体共______种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。根据要求回答下列相关问题:
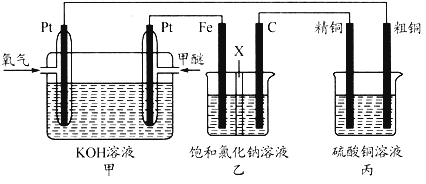
(1)通入氧气的电极为_____(填“正极”或“负极”),写出负极的电极反应式_____.
(2)铁电极为_____(填“阳极”或“阴极”),石墨电极的电极反应式为_____.
(3)反应一段时间后,乙装置中生成NaOH主要在_____(填“铁极”或“石墨极”)区.
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_____,反应一段时间,硫酸铜溶液浓度将_____(填“增大”“减小”或“不变”).
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下的体积为_____;丙装置中阴极析出铜的质量为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
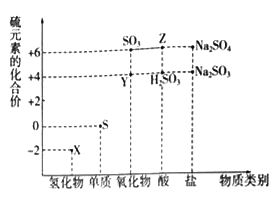
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成离分子树脂G和合成酚醛树酯的原料之一。相关的合成路线如下图所示:

已知:Ⅰ. (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
Ⅱ.![]()
请回答下列问题:
(1) 经质谱测定,有机物A的相对分子质量为164,燃烧8.2g有机物A,生成标准状况下11.2LCO2和5.4gH2O。则A的分子式是________,A中所含官能团的名称是________。
(2)B的结构简式________。
(3)C的名称是________,请写出在一定条件下C与足量新制氢氧化铜悬浊液反应的化学方程式________。
(4)D-F的反应类型是________,写出由C和苯酚合成酚醛树脂的化学方程式是___________。
(5)有机物![]() 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。
Ⅰ.分子中除苯环外,无其它环状结构;
Ⅱ.核磁共振氯谱显示为5组峰;
Ⅲ.能发生水解反应,不能与Na反应
Ⅳ.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24 B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量 D. 曲线C为Al与盐酸反应的图像
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com