
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24 B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量 D. 曲线C为Al与盐酸反应的图像
【答案】C
【解析】
按照金属活动性顺序:Na>Mg>Al可知,钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al;根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属在与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol;氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L,据以上分析解答。
按照金属活动性顺序:Na>Mg>Al可知,钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属在与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L;
A.结合以上分析可知,由于酸不足,所以生成氢气的量为:n(H2)=1/2n(HCl)=0.1×2÷2=0.1mol,所以标况下的体积为2.24L,A项正确;
B.结合以上分析可知,生成0.1mol的氢气需0.2mol的钠,根据题意可知,铝的物质的量也为0.2 mol,B项正确;
C.结合以上分析可知,Na不可能过量,若Na过量会与溶剂水反应,C项错误;
D.结合以上分析可知,则反应速率最慢的为铝,用时最长,则曲线C为Al与盐酸反应的图像,D项正确;
综上所述,本题选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素及其衍生物广泛存在于天然植物之中,是一类香料,也是医药中间体,尤其在抗癌、抗艾滋病领域有无限广阀的前景,今有一化学学习小组用如下方法合成香豆素:
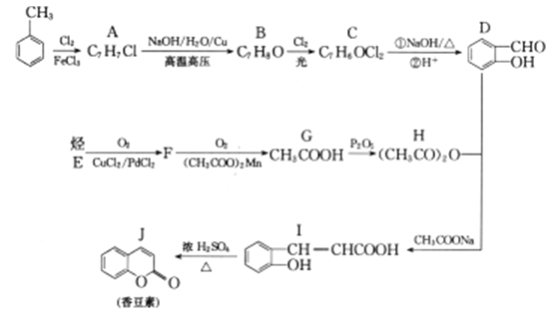
已知:(I)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基
(II)(CH3CO)2O+CH3CHO![]() 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O
(III)RCOOR'+ R"OH ![]() RCOOR"+ R'OH
RCOOR"+ R'OH
回答下列问题:
(1)烃E分子中只有一种化学环境的氢原子,则E的名称为________。
(2)化合物D分子中的官能团为_____、______。
(3)上述合成路径中B→C的反应类型为___________。
(4)C→D中第①步反应的化学方程式为_____________。
(5)满足下列条件的D的同分异构体(不包括D)有__________种。
①属于芳香族化合物 ②能与NaOH溶液反应
D的同分异构体中苯环上只有一个侧链且能发生银镜反应的同分异构体的结构简式为______。
(6)利用上述路径中的D还可以合成香豆素-3-羧酸,请完成其合成路径,其中①填反应条件,④填化学式或溶液名称,②③⑤填结构简式。_______________________
已知:(IV) 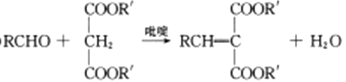
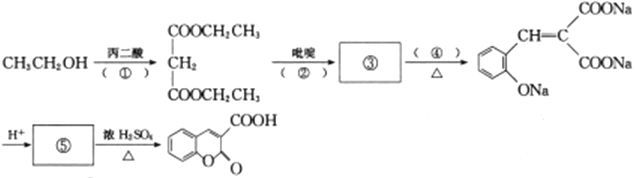 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
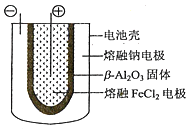
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g) ![]() CH3OH(g)△H1=-90.1kJ/mol
CH3OH(g)△H1=-90.1kJ/mol
(ii)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
水煤气变换反应:(iii)CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3=-41.1kJ/mol
CO2(g)+H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
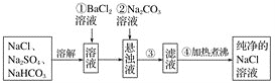
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com