
����Ŀ��2017��5��5�գ��й�������ɻ�C919�ɳɹ���Ϊ�˼�������������ɻ�ijЩ����ʹ����þ�Ͻ�
��1����̬þԭ�Ӻ�����ӵĹ������ʽΪ___________���������_________��������ͬ�ĵ��ӡ�
��2���ٵڶ������ܣ�Na_______Mg(���������������)����ԭ��Ϊ______________��
�����ȶ��ԣ�CaCO3��MgCO3����ԭ��Ϊ___________________________��
��3��þ�����ڹ�ҵ��������;�㷺��Ҳ�Ƕ�ֲ��������бز����ٵ���Ԫ�أ���ͼΪҶ���صĽṹʾ��ͼ��

��ͼ����Mg�γ���λ����Nԭ�ӵı��Ϊ________����д����������������
��Ҷ�����У�̼ԭ�ӵ��ӻ���ʽΪ________��
��4��̼��þ��һ���ڻ�����ҵ��;�㷺�Ľ���̼���ij��̼��þ�ľ���ṹ��ͼ1��ʾ��ͼ2Ϊ�丩��ͼ��

�پ�����Mg����λ��Ϊ________��
����֪����٤��������ֵΪNA����ͼ1�м����̼��þ���ܶ�Ϊ________g��cm-3.
���𰸡� 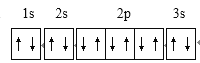 4 �� Naʧȥ1�����Ӻ�2p�ܼ�����ȫ�������ȶ�״̬���ʵڶ�������Na��Mg r(Ca2+)��r(Mg2+)��CaO������С��MgO�����ܣ���MgCO3���ֽ�ΪMgO���ȶ���CaCO3��MgCO3 �� sp2��sp3 6
4 �� Naʧȥ1�����Ӻ�2p�ܼ�����ȫ�������ȶ�״̬���ʵڶ�������Na��Mg r(Ca2+)��r(Mg2+)��CaO������С��MgO�����ܣ���MgCO3���ֽ�ΪMgO���ȶ���CaCO3��MgCO3 �� sp2��sp3 6 ![]()
����������1��þ������Ϊ12����̬þԭ�Ӻ�����ӵĹ������ʽΪ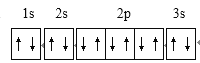 ���������1s��2s��2p��3s��4��������ͬ�ĵ��ӡ���2���ٵڶ������ܣ�Na>Mg����ԭ��ΪNaʧȥ1�����Ӻ�2p�ܼ�����ȫ�������ȶ�״̬���ʵڶ�������Na��Mg�������ȶ��ԣ�CaCO3��MgCO3����ԭ��Ϊr(Ca2+)��r(Mg2+)��CaO������С��MgO�����ܣ���MgCO3���ֽ�ΪMgO���ȶ���CaCO3��MgCO3 ����3����ͼ�Т� �ṩ�µ��Ӷԣ���Mg�γ���λ����Nԭ�ӵı��Ϊ�� ����Ҷ�����У��γ�4��������̼��sp3�ӻ����γ�2��������1��˫����̼��sp2�ӻ���̼ԭ�ӵ��ӻ���ʽΪsp2��sp3����4��ij��̼��þ�ľ���ṹ�پ�����Mg����λ��Ϊ6������֪����٤��������ֵΪNA����ͼ1��������þ����Ϊ12��1/6+2��1/2=3��CΪ6��̼��þ��ѧʽΪMgC2,��̼��þ���ܶ�Ϊ=
���������1s��2s��2p��3s��4��������ͬ�ĵ��ӡ���2���ٵڶ������ܣ�Na>Mg����ԭ��ΪNaʧȥ1�����Ӻ�2p�ܼ�����ȫ�������ȶ�״̬���ʵڶ�������Na��Mg�������ȶ��ԣ�CaCO3��MgCO3����ԭ��Ϊr(Ca2+)��r(Mg2+)��CaO������С��MgO�����ܣ���MgCO3���ֽ�ΪMgO���ȶ���CaCO3��MgCO3 ����3����ͼ�Т� �ṩ�µ��Ӷԣ���Mg�γ���λ����Nԭ�ӵı��Ϊ�� ����Ҷ�����У��γ�4��������̼��sp3�ӻ����γ�2��������1��˫����̼��sp2�ӻ���̼ԭ�ӵ��ӻ���ʽΪsp2��sp3����4��ij��̼��þ�ľ���ṹ�پ�����Mg����λ��Ϊ6������֪����٤��������ֵΪNA����ͼ1��������þ����Ϊ12��1/6+2��1/2=3��CΪ6��̼��þ��ѧʽΪMgC2,��̼��þ���ܶ�Ϊ=![]() =
=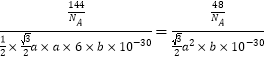 g��cm-3.
g��cm-3.


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
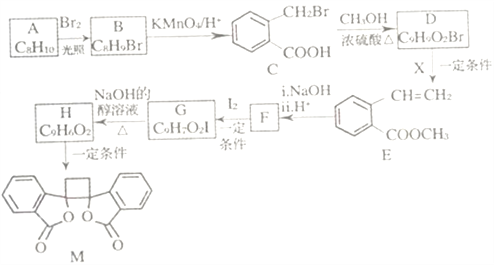
����Ŀ���ҹ�����������һ��ֲ���к��п������õĻ�����M����֪M�ĺϳ�·������ͼ��ʾ:
��֪:i.RCH2Br![]() R-HC=CH-R'��
R-HC=CH-R'��
ii.R-HC=CH-R'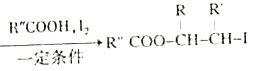 ��
��
iii.R-HC=CH-R'![]()
 (����R��R'��R"�����⡢������)��
(����R��R'��R"�����⡢������)��
(1)A�Ļ�ѧ����Ϊ_______��D�����������ŵ�������______����H����M�ķ�Ӧ����Ϊ_____��
(2)�����Ƚ��ķ�������������������л���ṹ������
�ٿ�����_______(����ס���������ס��˴Ź�������)���C����Է���������
�ڲⶨB�Ľṹ:B�ĺ˴Ź���������ʾΪ_____��塣
(3)1molM������NaOH��Һ��Ӧ������_____molNaOH��
(4)X�ĽṹʽΪ_____��F�Ľṹ��ʽΪ______ ��
(5)��C����H�Ļ�ѧ����ʽΪ__________��
(6)��������������B��ͬ���칹�干______��(�����������칹)��
�ٷ����廯���� ����E������ͬ������ ���ܷ���������Ӧ ������������ˮ��������Ȼ�����Һ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ������������������A��Bͬ���ڣ���̬��AB2��������C��Eԭ�Ӷ���һ��δ�ɶԵ��ӣ�C+��E-��һ�����Ӳ㣬Eԭ�ӵõ�һ�����Ӻ�3p���ȫ������D�����������D����������Ϊ40%���Һ���������������������FΪ��ɫ���ʣ���F+��F2+�������ӡ��ش��������⣺
��1��Ԫ�ص縺�ԣ�D____E (�������)��
��2��B��C�����۵�B_____C(�������)��
��3��AE4��Aԭ���ӻ������ʽΪ��________�ӻ������̬��������Ϊ_____________��
��4���⻯��ķе㣺B��D�ߵ�ԭ��______________��
��5��F�ĺ�������Ų�ʽΪ____________________________����F������������μ��백ˮ�Ȳ���������������ܽ�Ϊ����ɫ��Һ�������Ҵ�����������ɫ���壬�þ���Ļ�ѧʽΪ_______�����й��ڸþ�������˵������ȷ����_____________________��
A�������Ҵ���Ŀ���ǽ����ܼ��ļ��ԣ���ʹ��������
B��F��NH3֮��Ļ�ѧ��Ϊ���Ӽ�
C��������ᄃ���У�N����λԭ�ӣ�NH3Ϊ������
D����������Nԭ�����г�Ϊƽ�������Σ�������F������sp3�ӻ�
E����þ����ˮ��Һ�м���ŨBaCl2��Һ�а�ɫ��������
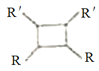
��6��Ԫ��X��ij��̬������Xn-�����е������ó���K��L���Ӳ㣬CnX�������С�ṹ��ԪΪ�����壬�ṹ��ͼ��ʾ���þ�����ÿ��Xn-��________���Ⱦ����C+���Ӱ�Χ����֪�þ�����ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA��CnX��Ħ������ΪM g/mol��C+��Xn-�����̾�����_____________nm�����г�����ʽ���ɣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�Ǻϳ��������֬G�ͺϳɷ�ȩ������ԭ��֮һ����صĺϳ�·������ͼ��ʾ��

��֪���� (R1��R2��R3��������)
(R1��R2��R3��������)
��![]()
��ش��������⣺
(1) �����ײⶨ���л���A����Է�������Ϊ164��ȼ��8.2g�л���A�����ɱ�״����11.2LCO2��5.4gH2O����A�ķ���ʽ��________��A�����������ŵ�������________��
(2)B�Ľṹ��ʽ________��
(3)C��������________����д����һ��������C����������������ͭ����Һ��Ӧ�Ļ�ѧ����ʽ________��
(4)D-F�ķ�Ӧ������________��д����C�ͱ��Ӻϳɷ�ȩ��֬�Ļ�ѧ����ʽ��___________��
(5)�л���![]() �ж���ͬ���칹�壬д��ͬʱ��������������һ��ͬ���칹��Ľṹ��ʽ_________��
�ж���ͬ���칹�壬д��ͬʱ��������������һ��ͬ���칹��Ľṹ��ʽ_________��
�����г������⣬��������״�ṹ��
�˴Ź���������ʾΪ5��壻
���ܷ���ˮ�ⷴӦ��������Na��Ӧ
�����ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ�س�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn��2K2FeO4��8H2O![]() 3Zn(OH)2��2Fe(OH)3��4KOH��������������ȷ����
3Zn(OH)2��2Fe(OH)3��4KOH��������������ȷ����
A. �ŵ�ʱ������ӦΪ��Zn��2e-��2OH-��Zn(OH)2
B. ���ʱ������ӦΪ��Fe(OH)3��3e-��5OH-��![]() ��4H2O
��4H2O
C. �ŵ�ʱÿת��3 mol���ӣ�������1 mol K2FeO4������
D. �ŵ�ʱ����������Һ�ļ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɳ�������� ����һ������ҩ������ڻ��������ȷβ���������һ�ֺϳ�·�����¡�
����һ������ҩ������ڻ��������ȷβ���������һ�ֺϳ�·�����¡�
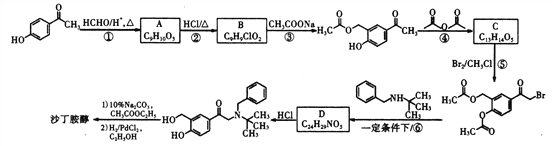
��1��ɳ�������ķ���ʽΪ_____________��C�й����ŵ�����Ϊ_____________��
��2���ٵķ�Ӧ����Ϊ____________���ķ�Ӧ����Ϊ____________��
��3��B�Ľṹ��ʽΪ_____________��
��4��A�����������·������۷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��5����������������B��ͬ���칹����________�֣������������칹������������һ�ֵĽṹ��ʽΪ_____________��
a.������������ȡ������ b.����NaHC03��Ӧ����CO2��
��6��д���Ա��ӡ���ȩ����������![]() ��Ϊԭ���Ʊ��߷���
��Ϊԭ���Ʊ��߷���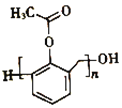 �ĺϳ�·�ߣ�____________________________________________________�����Լ���ѡ��
�ĺϳ�·�ߣ�____________________________________________________�����Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2 �������ΪKOH��Һ��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ�飬��ͼ��ʾ��

�ش��������⣺
��1������ȼ�ϵ�������������ĵ缫��Ӧ�ֱ�Ϊ________________ ��_______________ ��
��2���պ�K���غ�a��b�缫�Ͼ����������������a�缫�ϵõ�����_________���ѧʽ��������Ȼ�����Һ���ܷ�Ӧ����ʽΪ___________________��
��3����ÿ����ؼ���ͨ����Ϊ1 L(��״��)���ҷ�Ӧ��ȫ��������������ܲ������������Ϊ____________L(��״��)��
��4���������Ȼ�����Һ���Ϊ100mL�����һ��ʱ������²����ҺpHΪ13����Ҫʹ��Һ�ָ������ǰ��״̬��������Һ�мӣ���ͨ����__________����д���ʵĻ�ѧʽ��_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����Ľ���Na��Mg��Al�ֱ���100 mL 2 mol��L��1�����ᷴӦ��ʵ����������������V(���ۺ�Ϊ��״��)��ʱ��t�Ĺ�ϵ��ͼ��ʾ��������˵���������

A. x��2.24 B. �������ʵ���Ϊ0.2 mol
C. ��Ӧʱ��Na��Mg��Al������ D. ����CΪAl�����ᷴӦ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�齫SO2ͨ��Na2S��Na2SO3�Ļ����Һ���Ʊ����������(Na2S2O3)����װ������ͼ��ʾ(ʡ�Լг�װ��)������˵���������
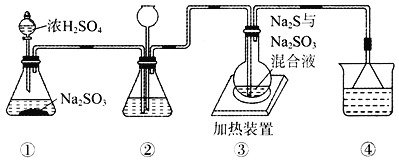
A. װ�âڵ�����֮һ�ǹ۲�SO2���������ʣ����е�Һ������DZ���NaHSO3��Һ
B. Ϊ��߲�Ʒ���ȣ�ʹ��ƿ��Na2S��Na2SO3ǡ����ȫ��Ӧ����![]()
C. װ�âܵ�����������β����ͬʱ��ֹ����
D. װ�â�Ҳ�����ڸ��������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com