
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

【答案】 < < sp3 分子晶体 水分子间存在氢键 [Ar]3d104s1(或1s22s22p63s23p63d104s1) [Cu(NH3)4]SO4·H2O ACE 6 ![]() ×107
×107
【解析】分析:本题考查元素的推断、电负性的比较、熔点和沸点高低的比较、原子杂化方式和晶体类型的判断、核外电子排布式的书写、配位化合物、晶胞的分析和计算。E原子得到一个电子后3p轨道全充满,E为Cl元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,C为Na元素;A、B的原子序数小于C,A和B同周期,固态AB2能升华,A为C元素,B元素为O元素;设D的最高正价为+x,D最高价氧化物中D与O的个数比为2:x,D最高价氧化物中D的质量分数为40%,2Ar(D):16x=40%:60%,![]() =
=![]() ,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
详解:E原子得到一个电子后3p轨道全充满,E为Cl元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,C为Na元素;A、B的原子序数小于C,A和B同周期,固态AB2能升华,A为C元素,B元素为O元素;设D的最高正价为+x,D最高价氧化物中D与O的个数比为2:x,D最高价氧化物中D的质量分数为40%,2Ar(D):16x=40%:60%,![]() =
=![]() ,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
(1)非金属性:Cl![]() S,元素的电负性:D(S)
S,元素的电负性:D(S)![]() E(Cl)。
E(Cl)。
(2)B的单质有O2和O3,O2、O3常温下呈气态;C的单质为Na,Na常温下呈固态;B、C单质熔点:B![]() C。
C。
(3)AE4的化学式为CCl4,中心原子C的价层电子对数为![]() (4-4
(4-4![]() 1)+4=4,C原子采用sp3杂化。CCl4固态晶体类型为分子晶体。
1)+4=4,C原子采用sp3杂化。CCl4固态晶体类型为分子晶体。
(4)B的氢化物为H2O,D的氢化物为H2S,B的氢化物(H2O)的沸点比D的氢化物(H2S)高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(5)F为Cu,Cu原子核外有29个电子,Cu原子核外电子排布式为1s22s22p63s23p63d104s1。向CuSO4溶液中逐滴加入氨水至沉淀完全溶解,发生的反应为CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+4NH3·H2O=[Cu(NH3)4](OH)2+4H2O,加入乙醇析出深蓝色晶体,该深蓝色晶体的化学式为[Cu(NH3)4]SO4·H2O。A项,加入乙醇的目的是降低溶剂的极性,促使晶体析出,A项正确;B项,Cu2+与NH3之间为配位键,B项错误;C项,该配合物中,配体为NH3,N原子上有孤电子对,N是配位原子,N提供孤电子对与Cu2+的空轨道形成配位键,NH3为三角锥型,C项正确;若Cu2+为sp3杂化,配离子内N原子排列为正四面体,D项错误;E项,SO42-在外界,该晶体溶于水电离出[Cu(NH3)4]2+和SO42-,向该晶体的水溶液中加入浓BaCl2溶液会产生白色BaSO4沉淀,E项正确;答案选ACE。
(6)根据晶胞,每个Xn-被6个等距离的C+包围。用“均摊法”,晶胞中含C+:12![]() =3,含Xn-:8
=3,含Xn-:8![]() =1,晶体的化学式为C3X,n=3;1mol晶体的质量为Mg,1mol晶体的体积为Mg
=1,晶体的化学式为C3X,n=3;1mol晶体的质量为Mg,1mol晶体的体积为Mg![]() ρg/cm3=
ρg/cm3=![]() cm3,1个晶胞的体积为
cm3,1个晶胞的体积为![]() cm3
cm3![]() NA=
NA=![]() cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,C+和Xn-间的最短距离为晶胞边长的一半,C+和Xn-间的最短距离为
cm,C+和Xn-间的最短距离为晶胞边长的一半,C+和Xn-间的最短距离为![]() cm=
cm=![]() 107nm。
107nm。


科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
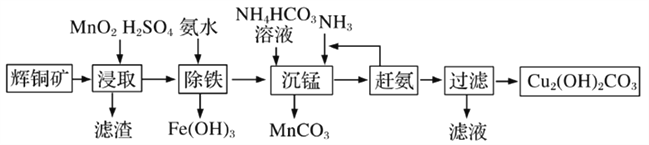
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________。
③写出“沉锰”反应时离子方程式___________。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
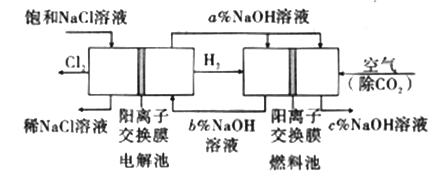
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
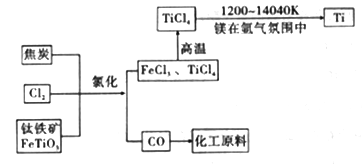
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将35.2铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(II)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为10 g,求
(1)此混合物中CO和CO2物质的量之比_____。
(2)CO的质量分数_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
![]()
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______,生成1molNa2FeO4转移电子数目为__________。
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是______;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________。
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法,并写出相应离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g) ![]() CH3OH(g)△H1=-90.1kJ/mol
CH3OH(g)△H1=-90.1kJ/mol
(ii)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
水煤气变换反应:(iii)CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3=-41.1kJ/mol
CO2(g)+H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com