
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1).用双线桥法分析上述反应(只需标出电子得失的方向和数目)__________。
(2).上述反应中氧化剂是__________,氧化产物是__________。
(3).上述反应中氧化剂与还原剂的物质的量之比为__________。
(4).若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是__________。
【答案】(1)

(2)HNO3Cu(NO3)2
(3)2∶3
(4)4.48 L
【解析】
试题(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,
则双线桥法标出电子得失的方向和数目为 ,
,
故答案为: ;
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物;(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,由反应及氮原子守恒可知,8mol硝酸反应时6mol硝酸体现酸性,2mol硝酸体现氧化性,3mol铜体现了还原性,故氧化剂与还原剂的物质的量之比为2:3;(4)由反应可知生成2molNO转移的电子为6mol,则反应中转移了0.6mol电子,产生的气体的物质的量为0.2mol,其在标准状况下的体积为0.2mol×22.4L/mol=4.48L。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.常温常压下,11.2LCO2所含分子数为0.5NA
C.H2SO4 的摩尔质量为98 g
D.6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
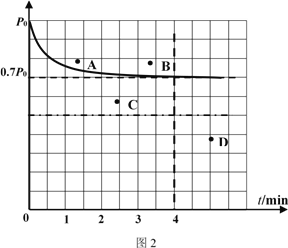
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
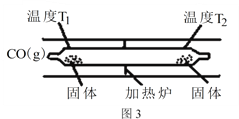
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应,属于氧化还原反应的是( )
A. CaCO3![]() CaO + CO2 ↑ B. 2NaOH +CO2
CaO + CO2 ↑ B. 2NaOH +CO2![]() Na2CO3+ H2O
Na2CO3+ H2O
C. NaOH+HCl==NaCl+H2O D. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
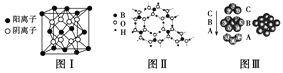
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中硼原子个数与极性键个数比为________。
(3)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氯水 | NaBr | 淀粉KI溶液 | 氧化性:Cl2>Br2>I2 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯与溴单质在铁催化剂作用下 发生取代反应 | |
D | 硝酸 | Na2SO3 | KMnO4溶液 | SO2能使KMnO4溶液褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com