
����Ŀ����ҵ�ϳ�ͨ�����·ֽ�FeSO4�ķ����Ʊ�Fe2O3,�仯ѧ����ʽΪ��2FeSO4![]() Fe2O3+SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ���,��������ʵ��
Fe2O3+SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ���,��������ʵ��
(1)�������Fe2O3ȡ����FeSO4���·ֽ�õ��Ĺ���,����һ����__________�ܽ�,�������Һ�м���������__________��Һ,����____________�������,��֤�������д���Fe2O3
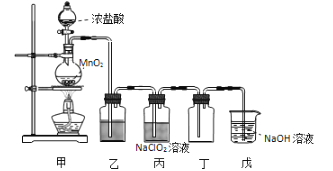
(2)�����������:��FeSO4���·ֽ����������ͨ����ͼ����װ����,�Լ���������������Ƿ���SO2��SO3��
������װ����������Ϊ_______________(��װ�����)
��ʵ������۲쵽װ��A��Ʒ����Һ______,װ��B BaCl2��Һ��__________,���֤��FeSO4���·ֽ�����������к���SO2��SO3��
��װ��C��NaOH��Һ��������_______________(�����ӷ���ʽ��ʾ����

���𰸡�ϡ����(��ϡ����) KSCN��Һ ��Һ��� BAC ��ɫ ��ɫ���� SO2+2OH-==SO32-+H2O
��������
��1��Fe3+�ļ��飺����������KSCN��Һ����Һ���Ѫ��ɫ��
��2��SO2��ʹƷ����Һ��ɫ��SO3ͨ�뵽BaCl2��Һ�У��������ᱵ��ɫ������
��1����FeSO4���·ֽ�õ��Ĺ����м���һ����ϡ����(��ϡ����)�ܽ⣬�����Һ�м���������KSCN��Һ����Һ���Ѫ��ɫ��˵����Fe3+���ɣ���˵�������д���Fe2O3��
�ʴ�Ϊ��ϡ����(��ϡ����)��KSCN��Һ����Һ��졣
��2�����Ȱѻ������ͨ�뵽�Ȼ�����Һ�У�������ɫ��������ͨ�뵽Ʒ����Һ�У�Ʒ����ɫ�����ͨ�뵽����������Һ�н���β���������ʴ�Ϊ��BAC ��
��SO2��ʹƷ����Һ��ɫ��SO3ͨ�뵽BaCl2��Һ�У��������ᱵ��ɫ�������ʴ�Ϊ����ɫ����ɫ������
��װ��C��NaOH��Һ�������dz�ȥ�����SO2����ֹ��Ⱦ�������ʴ�Ϊ��SO2+2OH-==SO32-+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֳ��Ϊ��ɫ��������ˮ�����Ҵ��Ĺ��壬������������������ơ������ơ���Ⱦ�ϵȡ�ʵ�������ù�ҵ����(���ؽ��������ú�۵ȶ��ʺ�ɫ)������������Ʊ���������ƾ���(Na2S2O3��5H2O)��ԭ�����£�Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3���ش��������⣺
Na2S2O3���ش��������⣺
(1)��ҵ���ƵĴ���
��18g��ҵ���Ƽ�����ƿ�У��ټ���150mL95%���Ҵ���Һ��8mLˮ������ͼ��ʾװ�ý��з�ˮԡ���ȣ�������40min�����ȹ��ˣ���ȴ�����衢�ᾧ����������ȥ�ϲ�ĸҺ�������95%���Ҵ���Һϴ�ӣ���ɣ��õ�Na2S��9H2O���塣ͼ������a��������_______���ù����л���40min��Ŀ����_______________________________��
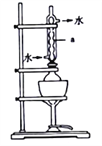
(2)��������Ƶ��Ʊ�
��ȡ�������Na2S��9H2O����14.4g��mgNa2CO3����Ϻ�������ƿ�У�����150mL����ˮ���Ⱥ�ͼ��ʾ��װ������Ȼ��Һ©���Ļ�����������6�����ʵ����ڸ������У�����ƿ��ͨ��SO2���壬����Һ������ʱ��ֹͣͨ��SO2���壬�Է�Ӧ����Һ���к��������������Ƶ����������(Na2S2O3��5H2O)��
���ʵ�����������6��Ŀ����_______________________________________��
��ʵ������У�ͨ��SO2һ��ʱ�����Һ�л����ɴ�������ɫ������Ȼ���ֱ���塣���ɵ���ɫ�����Ļ�ѧ����ʽΪ____________________________________����ͨ��SO2����ʱ��������ή����������ƵIJ��ʣ�ԭ����_______________________��
��Ϊ��߲�Ʒ���ȣ���Լԭ�ϣ�m=____g��
����Ӧ�����������Һ���к����������õ���������ƾ���(Na2S2O3��5H2O)�������������Ũ������ȴ�ᾧ�����ˡ�_____����ɡ��������ò�Ʒ������Ϊng����Na2S2O3��5H2O�IJ���Ϊ_____________%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ���������ԱӦ�ü����ģ����ṹ����C60������N60����֪����N60������ÿ����ԭ�Ӿ���N��N���������Nԭ�Ӷ��γ�8�����ȶ��ṹ����N��N���ļ���Ϊ167 kJ��mol��1����ش��������⣺
(1)N60������ɵľ���Ϊ______���壬���ۡ��е��N2______(��ߡ��͡�)��ԭ����________________________��
(2)1 mol N60�ֽ��N2ʱ���ջ�ų���������________ kJ(��֪![]() ���ļ���Ϊ942 kJ��mol��1)�������ȶ���N60________(�>������<������)N2��
���ļ���Ϊ942 kJ��mol��1)�������ȶ���N60________(�>������<������)N2��
(3)��(2)�о�N60����;(��һ��)________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�仯�У����ԭ�ӵ����ӣ����ܷ����ı���ǣ�������
A.������
B.������
C.���������
D.ԭ�Ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
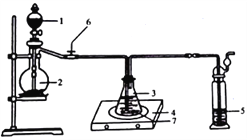
����Ŀ����������(ClO2)��һ�����������������۵�Ϊ-59�����е�Ϊ 11����Ũ�ȹ���ʱ�����ֽ⣬������ը��ij������ȤС��ͨ�������� NaClO2��Һ��Ӧ����ȡ����ClO2��װ������ͼ��ʾ��
(1)��װ����Բ����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽ��____________________��
(2)��װ���з����ķ�Ӧ���ܾ�����������뽫�䲹��������
��____________________________________________(�û�ѧ����ʽ��ʾ)��
��HClO + HCl + 2NaClO2 2ClO2��+ 2NaCl + H2O��
(3)Cl������ʱ��� ClO2��������������װ�������װ���ڲ��� ClO2���������Լӿ�����װ�����Լ�ƿ�ڵ�Һ����__________��ʵ������г���ͨ�������� N2ϡ�� ClO2����Ŀ����_______________________��
(4)��װ���ձ��� NaOH ��Һ���� ClO2���������� ClO2-��ClO3-���÷�Ӧ�����ӷ���ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ܴ������棬�ҵ������Լ���Ӧ�����ӷ���ʽ��д��ȷ����( )
ѡ�� | ������ | �����Լ� | ������Ӧ�����ӷ���ʽ |
A | Fe3+��I-��Cl- | NaOH��Һ | Fe3+ + 3OH- =Fe(OH)3�� |
B | K+��ClO-��SO42- | ���� | H++ClO- =HClO |
C | K+��OH-��Cl- | ����SO2 | SO2+ OH-=HSO3- |
D | H+��Fe2+�� SO42- | Ba(NO3)2��Һ | SO42-+ Ba2+ =BaSO4�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ��������о�����Ҫ���塣�밴Ҫ��ش��������⡣
��1����֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H<0������º����ܱյķ�Ӧ������Ͷ��1molN2��3molH2���ڲ�ͬ�¶��·ֱ��ƽ��ʱ���������NH3�����ʵ���������ѹǿ�仯��������ͼ��ʾ:
2NH3(g) ��H<0������º����ܱյķ�Ӧ������Ͷ��1molN2��3molH2���ڲ�ͬ�¶��·ֱ��ƽ��ʱ���������NH3�����ʵ���������ѹǿ�仯��������ͼ��ʾ:
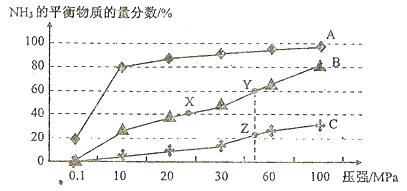
������A��B��C��Ӧ���¶����ɵ͵���������(��������ߵ���ĸ)_______��ͼ��X��Y��Z���ƽ�ⳣ����С��ϵ(����>����<������=��):K(X)__K(Y)_____K(Z).
�ڼ��ܼӿ컯ѧ��Ӧ�����������H2��ת���ʵĴ�ʩ��_______��
��Y���Ӧ��H2��ת������_______����������ʼͶ�Ͼ��ӱ��������������䣬����ƽ��ʱ����H2��ת���ʽ���(������������������������������) _______ ��
��2����ⷨ�ϳɰ�����ԭ��ת���ʴ������ߣ��������洫ͳ�Ĺ�ҵ�ϳɰ����ա���ⷨ�ϳɰ�������ԭ����װ����ͼ��ͼ����ʾ:
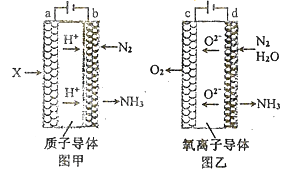
��ͼ��a�缫�ϵĵ缫��ӦʽΪ_______ͼ��d�缫�ϵĵ缫��ӦʽΪ_______��
����ͼ��ͼ��װ�õ�ͨ��ʱ����ͬ������ǿ����ȣ����Ч�ʷֱ�Ϊ80%��60%��������װ���в������������ʵ���֮��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��Fe2O3��Al2O3��Ʒ�ܽ��ڹ�����400mL 0.1molL��1��������Һ�У�Ȼ�������м���NaOH ��ҺʹFe3+��Al3+�պ���ȫ��������ȥNaOH ��Һ100mL����NaOH ��Һ��Ũ��Ϊ��������
A. 0.1 molL��1 B. 0.2 molL��1 C. 0.4 molL��1 D. 0.8 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����Ȼ�����γɻ�������������Ԫ�أ�CO��CO2��̼����������
��1���о��ͽ��������̼������ת�������ǵ�ǰ��ѧ�о���ǰ��������̫���ܵ������£�ȱ��������[Fe0.9O]�ֽܷ�CO2���������ͼ1��ʾ���������Ļ�ѧ����ʽ��______���ڹ�������ÿ����0.1molO2��ת�Ƶ���______mol��

��2���ڴ��������£���������̼��������Ϸ�Ӧ���ɼ��飬��Ŀǰ��ѧ��������̽���Ĵ��������еĶ�����̼�ķ���֮һ��
����֪��
���ۼ� | C=O | H��H | C��H | O��H |
����/(kJmol��1) | 745 | 436 | 413 | 463 |
��CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ��H=______kJmol��1��
CH4(g)+2H2O(g) ��H=______kJmol��1��
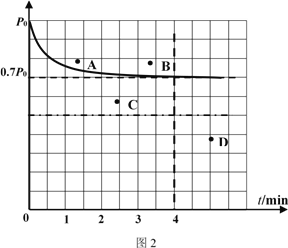
����1L�̶��ݻ����ܱ������м���4.0 mol H2(g)��1.0mol CO2����������������������þ�Ͻ𡢸���T1��ʹ֮��Ӧ������������������ѹǿ����ʱ��ı仯��ͼ2��ʾ����4 minʱ������������ܶ�Ϊ______���¶�T1 �£��÷�Ӧ�Ļ�ѧƽ�ⳣΪ______��������2 L�̶��ݻ����ܱ�������Ͷ�����������ͷ�Ӧ�¶Ⱦ����ֲ��䣬��Ӧ���´ﵽƽ��ʱ��Ӧ��ϵ�ڵ�ѹǿ�ĵ���______������ĸ����
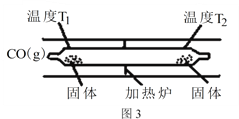
��3����ҵ�ϳ�ԭ����CO�����豸���ܵ�����������Ľ�����������Ӧ�������ʻ���������ʻ������ȷֽⷨ�Ʊ��ߴ�����ԭ�ϣ�Ҳ���л��ϳ��й���һ����̼��ԭ�ϣ�������������Ni(s)+4CO(g)![]() Ni(CO)4(g) ��H��0 Ni(CO)4(g)
Ni(CO)4(g) ��H��0 Ni(CO)4(g)![]() Ni(s)+4CO(g)����ͼ3��ʾ����ʯӢ��չܵ��¶�ΪT1һ�ˣ���������������CO(g)��һ��ʱ������¶�ΪT2��һ�˿ɵõ��������������¶�T1______T2����������������������������������Ӧ��ϵ��ѭ��ʹ�õ�����Ϊ______���ѧʽ����
Ni(s)+4CO(g)����ͼ3��ʾ����ʯӢ��չܵ��¶�ΪT1һ�ˣ���������������CO(g)��һ��ʱ������¶�ΪT2��һ�˿ɵõ��������������¶�T1______T2����������������������������������Ӧ��ϵ��ѭ��ʹ�õ�����Ϊ______���ѧʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com