
【题目】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
将18g工业硫化钠加入烧瓶中,再加入150mL95%的乙醇溶液和8mL水。用如图所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______,该过程中回流40min的目的是_______________________________。
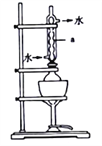
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4g和mgNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后落液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
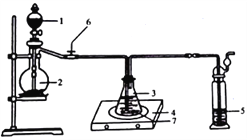
①适当调节螺旋夹6的目的是_______________________________________;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________。
③为提高产品纯度,节约原料,m=____g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________%。
【答案】 球形冷凝管 保证硫化钠充分溶解 控制气体流速,保证SO2充分反应,防倒吸 2Na2S+3SO2=3S↓+2Na2SO3 通入SO2时间过长,会使溶液酸性较强,导致Na2S2O3因反应而损耗 3.18 洗涤 4.48n(或100n/22.32)
【解析】(1)仪器a是球形冷凝管。回流40min的目的是为了保证硫化钠完全的溶解在溶剂中。
(2)①适当调节螺旋夹6的目的是控制通入的二氧化硫的流速,避免流速过快,使二氧化硫不能充分反应,同时也防止溶液倒吸。
②通入SO2一段时间后,溶液中会生成大量淡黄色沉淀一定是单质S,所以反应为2Na2S+3SO2=3S↓+2Na2SO3。通入的二氧化硫的时间过长,就会使溶液变为较强的酸性,而硫代硫酸钠会与酸反应(2H+ + S2O32- = S↓+ SO2↑+ H2O),导致产率降低。
③反应为2Na2S + Na2CO3 + 4SO2 = 3Na2S2O3 + CO2,所以Na2S∶Na2CO3=2:1。加入了Na2S·9H2O晶体14.4g,物质的量为0.06mol,所以碳酸钠为0.03mol,质量为3.18g。
④从溶液中得到固体应该经过:蒸发浓缩、冷却结晶、过滤、洗涤、烘干。加入Na2S·9H2O晶体14.4g,物质的量为0.06mol,所以得到的硫代硫酸钠应该为0.09mol,质量为0.09×248=22.32g,实际得到ng,所以产率为:100n/22.32%=4.48n%。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1molSiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和D2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
(1)该原子的质量数是________,质子数是________,中子数是________。
(2)请根据Rn的原子结构预测,氡气的化学性质________。
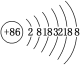
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加Ba(OH)2溶液生成蓝色沉淀,说明原溶液中有Cu2+
C.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
D.某溶液中加稀硫酸溶液产生无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
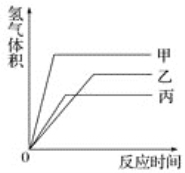
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
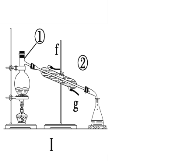
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
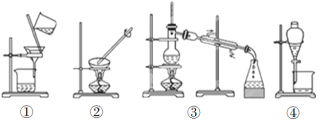
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________溶解,再向该溶液中加入适量的__________溶液,如有____________现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________(填装置序号)
②实验中如观察到装置A中品红溶液______,装置B BaCl2溶液中__________,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________(用离子方程式表示〕。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com