
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加Ba(OH)2溶液生成蓝色沉淀,说明原溶液中有Cu2+
C.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
D.某溶液中加稀硫酸溶液产生无色气体,说明原溶液中有CO32-
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。

(1)J基态原子的核外电子排布式为________。基态Q2+中未成对电子数为________;R和Y的简单离子与Na+半径大小顺序为________。
(2)X、Y、Z三种元素电负性由大到小的排序是________;X与Y的第一电离能:X________(填“>”“<”或“=”)Y,其理由是________。
(3)检验某溶液中是否含有Q3+的方法是_____________________________。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ca2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨以及含氮废水的处理一直是工业研究的热点。回答下列问题:
(1)已知:氢气的燃烧热为-285.8kJ/mol,17g氨气在纯氧中燃烧生成氮气和液态水的过程中放热382.6kJ,则工业合成氨的热化学方程式为_________________。
(2)500℃时,在容积固定的密闭容器中模拟工业合成氢N2+3H2![]() 2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
时间/min | c(N2)/mol/L | c(H2)/mol/L | c(NH3)/mol/L |
0 | 0.18 | 2.3 | 0 |
5 | 0.08 | ||
6 | 0.08 | ||
10 | 0.06 | 1.94 | 0.24 |
500℃时,该反应的化学平衡常数K=_______L2·mol-2;5min内,反应的平均速率v(H2)_____ mol·L-1·min-1;6min时,某一条件发生了改变,可能是_____(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.分离出NH3
(3)无机含氮废水主要含有铵氮(NH4+)和硝氮(NO3-)。可使用电化学氧化法处理铵氮废水,原理是溶液中的NH4+直接在电极上放电生成无毒物质,该过程阳极上的电极反应式为_______________。为研究电化学氧化法去除铵氮的影响因素,在实验室中以石墨作电极模拟对高浓度铵氮废水进行电化学氧化处理,得到如下3组图像:



通过分析上述图像可知,最适宜选用的条件是___________、以及初始pH为11的碱性溶液。实验中,铵氮去除率总是高于总氮去除率的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
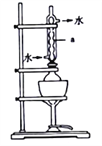
将18g工业硫化钠加入烧瓶中,再加入150mL95%的乙醇溶液和8mL水。用如图所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______,该过程中回流40min的目的是_______________________________。
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4g和mgNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后落液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
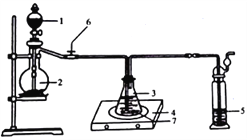
①适当调节螺旋夹6的目的是_______________________________________;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________。
③为提高产品纯度,节约原料,m=____g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列是A、B、C、D、E五种短周期元素的相关数据:
A | B | C | D | E | |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________。
A.![]() B.CH4
B.CH4
C.CH2==CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键:____________。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是______(化学式),理由是____。
(4)B、D形成的氢化物沸点:________更高,热稳定性________更强。(写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com