
【题目】下表所列是A、B、C、D、E五种短周期元素的相关数据:
A | B | C | D | E | |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________。
A.![]() B.CH4
B.CH4
C.CH2==CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键:____________。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是______(化学式),理由是____。
(4)B、D形成的氢化物沸点:________更高,热稳定性________更强。(写化学式)
【答案】 D F-H…F、F-H…O、O-H…F、O-H…O SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大 H2O H2O
【解析】元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,(1)分子中含有sp和sp3 杂化方式,说明分子中中心原子含有2个和4个价层电子对,A.![]() 中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,选项A错误;B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,选项B错误;C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,选项C错误;D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,选项D正确;E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,选项E错误;答案选D;(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O;(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;(4)B、D形成的氢化物H2O和H2S,由于H2O存在氢键,故沸点:H2O更高,热稳定性H2O更强。
中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,选项A错误;B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,选项B错误;C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,选项C错误;D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,选项D正确;E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,选项E错误;答案选D;(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O;(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;(4)B、D形成的氢化物H2O和H2S,由于H2O存在氢键,故沸点:H2O更高,热稳定性H2O更强。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加Ba(OH)2溶液生成蓝色沉淀,说明原溶液中有Cu2+
C.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
D.某溶液中加稀硫酸溶液产生无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
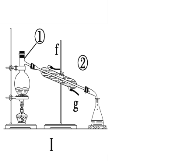
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
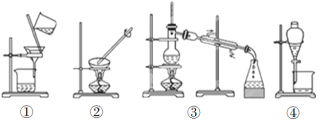
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向XmL0.01mol/L的氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的POH=—lgc(OH-)、温度随加入的硫酸溶液体积的变化如图所示。下列说法正确的是

A. X=20
B. b点时溶液的POH=PH
C. a,b,d三点NH3·H2O的电离常数: K(b)>K(d)>K(a)
D. c点对应的溶液中:C(SO42-)>C(NH4+)>C(H+)>C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com