
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
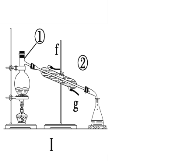
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
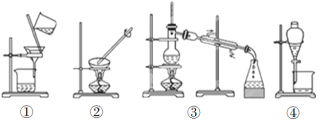
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
(4)装置②中玻璃棒的作用是__________________________________。
【答案】蒸馏烧瓶 直形冷凝管温度计g③②①④搅拌,使受热均匀,防止因局部过热而造成液滴飞溅
【解析】
(1)根据仪器的结构可知,①为蒸馏烧瓶,②为直形冷凝管;
(2)利用蒸馏装置分离酒精和水的混合物,必须使用温度计,即还缺少的仪器为温度计;冷凝时需要逆向冷却,即冷凝管下口是进水口,上口是出水口,所以②中进水口是g;
(3)①装置是用来分离固液混合物的,是过滤;②装置是用来分离易溶性的物质和液体混合物的操作,属于蒸发;③装置是用来分离互溶的液体混合物,属于蒸馏;④装置是用来分离互不相溶的液体混合物,属于分液;则
a、从海水中提取蒸馏水,用蒸馏方法,即选择③;
b、分离氯化钠和水,用蒸发的方法,即选择②;
c、分离碳酸钙和水,碳酸钙难溶于水,用过滤的方法,即选择①;
d、分离植物油和水,植物油不溶于水,会分层,用分液的方法,即选择④
(4)装置②是蒸发,其中玻璃棒的作用是搅拌,使溶液受热均匀,防止因局部过热而造成液滴飞溅。


科目:高中化学 来源: 题型:
【题目】溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
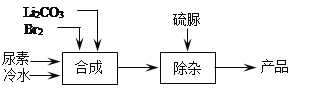
已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O![]() HBr +HBrO;
HBr +HBrO;
ⅱ._____;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
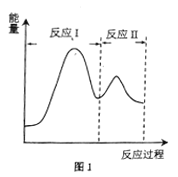
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为S + KNO3 + C→K2S + N2↑+ CO2↑,根据该反应回答下列问题:
(1)请写出配平后的化学方程式_____________________________________________。
(2)写出该反应的氧化剂_____________、还原剂______________。
(3)用双线桥法标出该反应电子转移的方向和数目____________________________。
(4)若该反应有48克硫完全反应,则转移电子的物质的量为____________,生成氧化产物的质量为__________。
(5)若该反应转移了0.6mol电子,则生成的气体在标准状况下的体积为___________。所得气体的平均相对分子质量为________________。
(6)若生成的氧化产物的质量比还原产物的质量少12克,则转移电子的物质的量为____________,参加反应的碳的质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种具有果香味的合成香料,如图所示为合成X的一种流程。 E是日常生活中常见的一种有机物,碳、氢的质量分数分别约为52.17% 、13.04% ,其余为氧,E的相对分子质量为46,其中含有甲基和亚甲基(—CH2—)。
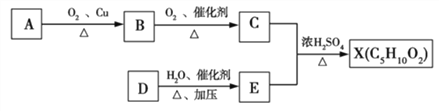
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是_____,E的结构简式是_______。
(2)D→E的化学反应类型为________。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是___。
(4)写出和E是同系物且差2个碳原子能和钠反应的所有同分异构体的结构简式_______________________________________________。
(5)反应C + E![]() X的化学方程式为____________________________。
X的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 从1L1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制备0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.热的碳酸钠溶液碱性较强,可用于洗涤油污
B.液氨具有还原性,可用作制冷剂
C.石墨具有导电性,可用于制铅笔芯
D.浓硫酸具有强氧化性,可用于干燥H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如: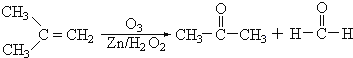
据以上线索和下列反应事实,确定C7H14的结构和名称:
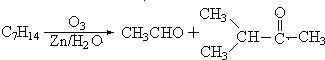
(1)该烃的结构简式是_______________________________。
(2)名称是_______________________________。
Ⅱ.把不饱和烃在催化剂存在下用O3氧化则生成有羰基的化合物,其规律可用下式表示:![]() 。现把一定量的以分子式为C4H8的不饱和烃的混合体。用上述方法进行氧化,生成0.5mol酮,1.5mol醛,其中含甲醛0.7mol,另外把1.0mol混合气体进行加氢反应,生成1.0mol饱和烃的混合气体。则上述混合气体经臭氧氧化后 可生成的物质:(用结构简式表示):_________________。
。现把一定量的以分子式为C4H8的不饱和烃的混合体。用上述方法进行氧化,生成0.5mol酮,1.5mol醛,其中含甲醛0.7mol,另外把1.0mol混合气体进行加氢反应,生成1.0mol饱和烃的混合气体。则上述混合气体经臭氧氧化后 可生成的物质:(用结构简式表示):_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com