
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
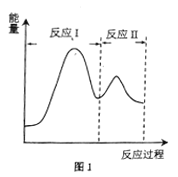
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

【答案】 CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH=+249.1kJ/mol I
2CO(g)+2H2(g) ΔH=+249.1kJ/mol I ![]() 80% p3>p2>p1 该反应为气体分子数增大的反应,压强增大,平衡逆移,甲烷的体积分数增大 > CH4+4CO32--8e-=5CO2+2H2O 0.1
80% p3>p2>p1 该反应为气体分子数增大的反应,压强增大,平衡逆移,甲烷的体积分数增大 > CH4+4CO32--8e-=5CO2+2H2O 0.1
【解析】(l)已知CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) 反应的ΔH=[2(-110.4)+0]kJ·mol-[(-395)+(-74.9)]kJ·mol=+249.1kJ/mol ,即CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为CH4(g)+CO2(g)
2CO(g)+2H2(g) 反应的ΔH=[2(-110.4)+0]kJ·mol-[(-395)+(-74.9)]kJ·mol=+249.1kJ/mol ,即CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH=+249.1kJ/mol;
2CO(g)+2H2(g) ΔH=+249.1kJ/mol;
(2)根据能量曲线图可知,反应Ⅰ反应物活化能大,反应速率慢,而反应Ⅱ反应速率较快,则总反应的反应速率取决于慢反应,即反应I;
(3)可逆反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=
2CO(g)+2H2(g)的平衡常数表达式Kp=![]() ;
;
(4)①设a点时CH4的转化率为α
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始物质的量(mol) 1 1 0 0
变化物质的量(mol) α α 2α 2α
变化后物质的量(mol) 1-α 1-α 2α 2α
则: ![]() =
=![]() ,解得:α=80%;
,解得:α=80%;
② 该反应为气体分子数增大的反应,压强增大,平衡逆移,甲烷的体积分数增大,故p3>p2>p1;温度为Tl℃、压强为P3时,b点处恒压曲线P3上方,CH4的含量比平衡时高,则此时反应应正向进行,即v(正)>v(逆;
(5)燃料电池通O2的极为正极,通CH4的极为负极,即电极A为负极,负极上CH4失电子发生氧化反应,生成CO2,电极反应式为CH4+4CO32--8e-=5CO2+2H2O;若电极B附近通入1m3空气(假设空气中O2的体积分数为20% ),则参加反应的O2的物质的量为1000L×20%÷22.4L/mol,根据电子守恒可知,消耗CH4体积为1000L×20%÷22.4L/mol×![]() ×22.4L/mol=100L=0.1m3。
×22.4L/mol=100L=0.1m3。


科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
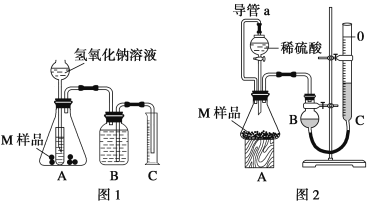
(1)写出实验1中可能发生反应的离子方程式:______________________________。
(2)实验1装置中小试管的作用是__________________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:
①___________________②___________________。
(4)M样品中铜的质量的数学表达式为(用V1和V2 表示):__________________________。
(5)实验1进行实验前,B瓶中水没有装满,使测得气体体积____________ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________。
(6)该实验需要0.50 mol·L-1的NaOH溶液470 mL,请回答下列问题:
①配制时应称量______g NaOH,称量时需要托盘天平、______、______ (填仪器名称)。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(7)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7).
(1)用离子方程式表示该溶液中存在的三个平衡体系______________、_______________、___________________
(2)溶液中各离子的物质的量浓度由大到小顺序为_____________________________________________________
(3)溶液中粒子中浓度为0.1mol/L的是________________,浓度为0.05mol/L的是____________________
(4)物质的量之和为0.lmol的两种粒子是______________与__________
(5)CH3COO-和OH-的物质的量之和比H+多________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活关系密切。下列关于生活中常见物质的说法,不正确的是( )
A.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料
B.天然植物油没有恒定的熔沸点,常温下难溶于水
C.所有的油脂、糖类和蛋白质都能发生水解反应
D.麦芽糖及其水解产物均能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的实验方法正确的是
A. 除去乙酸乙酯中的少量乙酸:加入KOH溶液,充分反应后,弃去水溶液
B. 除去苯酚中的少量甲苯:加入酸性高锰酸钾溶液,充分反应后,弃去水溶液
C. 除去苯中少量的甲苯:加高锰酸钾溶液,振荡,分液
D. 除去乙醇中少量的水:加足量生石灰,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
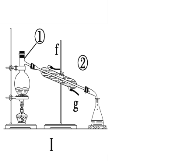
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
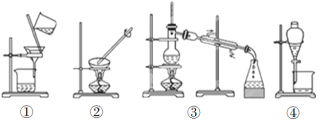
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
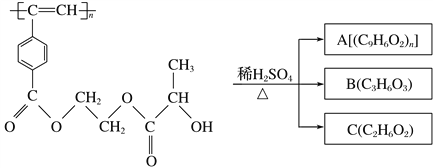
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com